Тренировочный вариант №1 ЕГЭ по химии-2021CHEMEGE.RU
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1) N 2) Rb 3) Al 4) P 5) Cs |
1. Определите атомы каких из указанных в ряду элементов имеют три неспаренных электрона на внешнем уровне. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые не образуют кислотные оксиды. Расположите выбранные элементы в порядке увеличения их радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, атомы которых образуют летучие водородные соединения состава ЭН3
 Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выбрать два вещества, в которых присутствует водородная связь:
1) бензол
2) фенол
3) этанол
4) кумол
5) толуол
Запишите номера выбранных ответов.
5. Установите соответствие между химическим элементом и высшим гидроксидом, который он образует: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
| ЭЛЕМЕНТ | ВЫСШИЙ ГИДРОКСИД |
| А) Br | 1) НЭО4 |
| Б) Ba | 2) Н2ЭО4 |
| В) Cr | 3) Э(ОН)2 |
| 4) Э(ОН)3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня веществ выберите два вещества, которые реагируют с концентрированной азотной кислотой без нагревания.
1) медь
2) железо
3) алюминий
4) кальций
5) золото
Запишите номера выбранных ответов.
7. Вещество Х разделили на две пробирки. В первую пробирку добавили гидроксид калия, во вторую добавили раствор слабого электролита Y. В обеих пробирках выпал осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) KF
2) NaHCO3
3) NH3·H2O
4) Mg3(PO4)2
5) Fe2(SO4)3
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между формулой вещества и реагентами, с каждым
из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Cl2 | 1) H2O, K2SO4, ZnBr2 |
| Б) Mg | 2) CO2, HCl, CuO |
| В) SiO2 | 3) FeCl2, S, NaOH |
| Г) Al2O3 | 4) Na2CO3, NaBr, BaO |
| 5) HF, CaO, NaOH |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Fe + H2SO4 (разб ) = | 1) Fe2(SO4)3, H2O |
| Б) Fe + H2SO4 (конц.) → | 2) FeSO4, H2 |
| В) FeO + H2SO4 (разб ) = | 3) Fe2(SO4)3, SO2, H2O |
| Г) Fe2O3 + H | 4) Fe2(SO4)3, H2 |
| 5) FeSO4, H2O | |
| 6) FeSO4, SO2, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами Х и Y.
1) HNO3
2) NO2
3) H2O
4) NaOH
5) Cu(OH)2
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
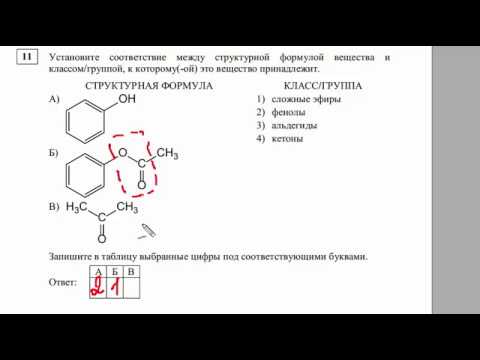
11. Установите соответствие между названием вещества и классом/группой, к которому(-й) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) трилинолеин | 1) алканы |
| Б) глицин | 2) аминокислоты |
| В) кумол | 3) многоатомные спирты |
| 4) сложные эфиры | |
| 5) арены | |
| 6) простые эфиры |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, в молекуле каждого из которых все атомы углерода находятся в sp3-гибридном состоянии.
1) дивинил
2) бутановая кислота
3) углекислый газ
4) циклопентан
5) изооктан
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые могут быть в одну стадию получены из 1,4-дибромпентана.
1) пентен-1
2) изопрен
3) пентадиен-1,3
4) циклопентан
5) метилциклобутан
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, при взаимодействии которых с альдегидами образуется осадок.
1) CuO
2) Br2
3) [Ag(NH3)2]OH
4) FeCl3
5) Cu(OH)2
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, которые могут быть в одну стадию получены из аминоуксусной кислоты.
Из предложенного перечня выберите два вещества, которые могут быть в одну стадию получены из аминоуксусной кислоты.
1) этиламин
2) уксусная кислота
3) метиламин
4) этаналь
5) гидроксоуксусная кислота
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между названием арена и алканом, при дегидроароматизации которого образуется этот арен. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ АРЕНА | НАЗВАНИЕ АЛКАНА |
| А) бензол | 1) гексан |
| Б) толуол | 2) 1,3,4-триметилпентан |
| В) о-диметилбензол | 3) 2,4-диметилгексан |
| Г) м-диметилбензол | 4) гептан |
| 5) 3-метилгептан | |
| 6) нонан |
Запишите в поле ответа выбранные цифры в нужной последовательности
17. Установите соответствие между реагентами и органическим веществом, которое является продуктом реакции К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между реагентами и органическим веществом, которое является продуктом реакции К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) CH3Cl + CH3COONa | 1) (CH3CO)2O |
| Б) CH3CH2ONa + CH3COCl | 2) CH3COOCH3 |
| В) СH3COONa + NaOH (сплавление) | 3) CH3CH2OH |
| Г) CH3COONa (электролиз р-ра) | 4) CH4 |
| 5) C2H6 | |
| 6) CH3COOCH2CH3 |
Запишите в поле ответа выбранные цифры в нужной последовательности
18. Задана следующая последовательность превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все пары веществ, каждая из которых дает реакцию, протекающую без изменения степеней окисления.
1) Fe2O3 + H2SO4
2) Na2O2 + СO2
3) FeO + HNO3
4) Fe2(SO4)3 + KI
5) Na2ZnO2 + H2S
Запишите номера выбранных ответов
20. Из предложенного перечня выберите все вещества, добавление которых приведет к увеличению скорости реакции.
3C2H4 + 2KMnO4 + 4H2O = 3HOCH2CH2OH + 2MnO2 + 2KOH
1) MnO2
2) KMnO4
3) С2H4
4) HOCH2CH2OH
5) HCl
Запишите номера выбранных веществ.
21. Установите соответствие между уравнением реакции и процессом, который протекает с марганцем в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | МАРГАНЕЦ |
| А) 2Mn(OH)2 + O2 + 2H2O = 2Mn(OH)4 | 1) восстанавливается |
| Б) 2KMnO4 = MnO2 + K2MnO4 + O2 | 2) окисляется |
| В) 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl | 3) восстанавливается и окисляется |
| Г) 2KMnO4 + H2SO4 = K2SO4 + Mn2O7 + H2O | 4) не окисляется и не восстанавливается |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между названием элемента и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ЭЛЕМЕНТА | ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
| А) кислород | 1) водного раствора сульфида ртути (II) |
| Б) алюминий | 2) расплава иодида кальция |
| В) ртуть | 3) водного раствора хлорида ртути (II) |
| Г) хлор | 4) водного раствора бромида алюминия |
| 5) раствора Al2O3 в расплаве криолита |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между формулой соли и окраской лакмуса в водном растворе этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ОКРАСКА ЛАКМУСА |
| А) NaCN | 1) красный |
| Б) NaMnO4 | 2) синий |
| В) KClO2 | 3) фиолетовый |
| Г) RbNO3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему.
СH3СООС2Н5(р-р) + Н2О(ж) ↔ C2H5ОН(р-р) + СH3СООН(р-р)
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) понижение общего давления | 1) смещается в сторону продуктов |
| Б) введение катализатора | 2) смещается в сторону реагентов |
| В) добавление уксусной кислоты | 3) не происходит смещения равновесия |
| Г) понижение температуры |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между формулами веществ и признаками протекания реакции, которые наблюдаются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАКИ ПРОТЕКАНИЯ РЕАКЦИИ |
| А) метаналь + аммиачный раствор оксида серебра → | 1) образование осадка сложного вещества |
| Б) пропанол + натрий | 2) ярко-синий раствор |
| В) уксусная кислота + сода | 3) выделение газа |
| Г) глицерин + гидроксид меди (II) | 4) выделение металлического осадка |
| 5) обесцвечивание раствора |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между химической посудой и способом ее применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКАЯ ПОСУДА | ПРИМЕНЕНИЕ |
| А) пипетка | 1) добавление по каплям точного объема жидкости |
| Б) бюретка | 2) набор порции жидкости |
| В) тигель | 3) нагревание в печи твердого образца |
| 4) хранение твердого образца |
Запишите в поле ответа выбранные цифры в нужной последовательности.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности.
27. Вычислите массу 14%-ного раствора соли (в граммах) , при добавлении к которому 10 воды образуется раствор с массовой долей 7%.. (Запишите число с точностью до десятых ).
28. В результате реакции, термохимическое уравнение которой
2Сl2O7(г) = 2Cl2(г) + 7O2(г) + 570 кДж,
выделилось 342 кДж теплоты. Вычислите массу разложившегося оксида хлора. Относительную атомную массу хлора примите равной 35,5. Ответ запишите в граммах. (Запишите число с точностью до десятых ).
29. Вычислите объем газа, который выделится при полном растворении образца меди массой 76,8 г в разбавленном растворе азотной кислоты. Полученный газ горит в атмосфере кислорода. Объем газа измерен при н.у. Ответ запишите в литрах. (Запишите число с точностью до сотых).
Для выполнения заданий 30, 31 используйте следующий перечень веществ: разбавленная азотная кислота, тетрагидроксоалюминат калия, хлорид серебра, пирит, перманганат натрия, сульфат бария. Допустимо использование водных растворов веществ (если они образуют водные растворы). |
30. Из предложенного перечня веществ выберите вещества, между которыми окислительно — восстановительная реакция протекает с выделением бурого газа. В ответе запишите уравнение только одной из возможных окислительно — восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
18HNO3 + FeS2 = Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O
N+5 + 1e = N+4
2Fe+2 − 2e = 2Fe+3
4S− − 28e = 4S+6
HNO3 (N+5) — окислитель
FeS2 (Fe+2, S−) — восстановитель
31. Из предложенного перечня веществ выберите соль и вещество, которое вступает с этой солью в реакцию ионного обмена. При этом не наблюдается выпадение осадка. Запишите молекулярное, полное и сокращенное ионное уравнения этой реакции.
K[Al(OH)4] + 4HNO3 = KNO3 + Al(NO3)3 + 4H2O
K+ + [Al(OH)4]– + 4H+ + 4NO3– = K+ + NO3– + Al3+ + 3NO3– + 4H2O
[Al(OH)4]– + 4H+ = Al3+ + 4H2O
32. При нагревании простого кристаллического вещества А, твердого, с металлическим блеском, с белым фосфором образуется вещество В. Известно, что при растворении вещества В в воде образуются две кислоты: одноосновная и двухосновная, а при окислении этого же вещества подкисленным раствором перманганата калия — трехосновная кислота С и вещество А. Кислота С применяется для получения газообразного йодоводорода из кристаллического йодида натрия. Напишите уравнения четырех описанных реакций.
2P + 3I2 = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
2PI3 + 2KMnO4 + 3H2SO4 = 2H3PO4 + 3I2 + 2MnSO4 + K2SO4
H3PO4 + NaI(тв) = NaH2PO4 + HI
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Образец нитрата железа (II) полностью разложили, масса продукта реакции оказалась на 10 г меньше массы исходной соли. Твердый продукт реакции растворили в 200 г 7,3% соляной кислоты, после чего к раствору добавили 300 г 15,8% раствора сульфита калия. Найдите массовую долю хлорида калия в полученном растворе.
4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2 (1)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (2)
2HCl + K2SO3 = 2KCl + SO2 + H2O (4)
2FeCl3 + K2SO3 + H2O = 2FeCl2 + K2SO4 + 2HCl (3)
Пусть количество исходного нитрата железа (II) равно х моль, тогда количество оксида железа (III) равно х/2 моль.
m(Fe(NO3)2) = 180х г
m(Fe2O3) = 80х г
180х — 80х = 10
х = 0,1 моль
n(Fe2O3) = 0,05 моль
m(Fe2O3) = 160*0,05 = 8 г
m(HCl) = 200*0,073 = 14,6 г
n(HCl) = m/M = 14,6/36,5 = 0,4 моль
В реакции (2) соляная кислота в избытке, расчет ведем по оксиду железа (III):
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (2)
n(FeCl3) = 0,1 моль
nост(HCl) = 0,4 — 6*0,05 =0,1 моль
Реакция (3): 2FeCl3 + K2SO3 + H2O = 2FeCl2 + K2SO4 + 2HCl
m(K2SO3) = 300*0,158 = 47,4 г,
n(K2SO3) = m/M = 47,4/158 = 0,3 моль, n(FeCl3) = 0,1 моль
Хлорид железа (III) в недостатке:
nост(K2SO3) = 0,25 моль,
n(FeCl2) = 0,1 моль
nобр(HCl) = 0,1 моль, nобщ(HCl) = 0,2 моль
Далее протекает реакция (4):
2HCl + K2SO3 = 2KCl + SO2 + H2O
Сульфит калия в избытке, расчет ведем по соляной кислоте:
nост(K2SO3) = 0,15 моль,
nобр, 1(KCl) = 0,2 моль
nобр(SO2) = 0,1 моль, mобр(SO2) = 6,4 г
Оставшийся сульфит калия реагирует с хлоридом железа (II):
FeCl2 + K2SO3 = 2KCl + FeSO3
Сульфит калия снова в избытке:
nобр, 2(KCl) = 0,2 моль
n(FeSO3) = 0,1 моль, m(FeSO3) = 13,6 г
nобщ(KCl) = 0,4 моль, m(KCl) = 29,8 г
mр-ра = m(Fe2O3) + mр-ра(HCl) + mр-ра(K2SO3) — mобр(SO2) — m(FeSO3) = 8 + 200 + 300 — 6,4 — 13,6 = 488 г
w(KCl) = 29,8/488 = 0,061 или 6,1%
Ответ: 6,1%
35. При сгорании органического вещества массой 15,2 г образуется 13,44 л (н у ) углекислого газа и 14,4 г воды. Известно, что это вещество образуется при окислении углеводорода нейтральным раствором перманганата калия. На основании данных условиях задачи:
При сгорании органического вещества массой 15,2 г образуется 13,44 л (н у ) углекислого газа и 14,4 г воды. Известно, что это вещество образуется при окислении углеводорода нейтральным раствором перманганата калия. На основании данных условиях задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу исходного органического вещества, однозначно отражающую порядок связи атомов в молекуле;
4) напишите уравнение реакции взаимодействия этого вещества с уксусной кислотой.
Тренировочный вариант №2 ЕГЭ по химии-2021 CHEMEGE.RU
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1) О 2) Ва 3) Li 4) Cl 5) Са |
1. Определите, атомы каких из указанных в ряду элементов имеют ровно один неспаренный электрон в основном энергетическом состоянии. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые не образуют летучие водородные соединения с водородом. Расположите выбранные элементы в порядке увеличения их радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, у которых разница между максимально возможной и минимально возможной степенями окисления равна двум. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выбрать два вещества, в которых присутствует водородная связь.
1) этаналь
2) этилацетат
3) этиленгликоль
4) аланин
5) этан
Запишите в поле ответа номера выбранных соединений.
5. Установите соответствие между формулой соли и ее типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ТИП СОЛИ |
| А) KMnO4 | 1) кислая |
| Б) NH4Cl | 2) средняя |
| В) КНСО3 | 3) двойная |
| 4) основная |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня веществ выберите два вещества, которые не реагируют концентрированной азотной кислотой без нагревания.
1) серебро
2) железо
3) хром
4) натрий
5) медь
Запишите номера выбранных ответов.
7. Даны две пробирки с раствором соли Х. В одну из них добавили небольшое количество раствора вещества Y, при этом наблюдали образование осадка без выделения газа. В другую пробирку прилили раствор сульфита калия, при этом наблюдали образование осадка и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
В другую пробирку прилили раствор сульфита калия, при этом наблюдали образование осадка и выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Ca(OH)2
2) KHCO3
3) BaCl2
4) CrCl3
5) HBr
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) HBr | 1) O2, H2S, KOH |
| Б) SO2 | 2) Cl2, Fe2O3, Mg |
| В) CuO | 3) O2, H2SO4, H2O2 |
| Г) ZnS | 4) NaOH, Cl2, CH4 |
| 5) NH3, Fe, HCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Na[Al(OH)4] + H2S | 1) NaHS, Al(OH)3, H2O |
| Б) Na[Al(OH)4] + SO2 | 2) Na2S, Al2S3, H2O |
| В) AlCl3 + Na2S раствор | 3) NaHSO3, Al(OH)3, H2O |
| Г) AlCl3 + Na2SO3 раствор | 4) NaCl, Al(OH)3, SO2 |
| 5) NaCl, Al2S3 | |
| 6) NaCl, Al(OH)3, H2S |
Запишите в поле ответа выбранные цифры в нужной последовательности.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами Х и Y.
1) Cl2
2) HCl
3) Fe
4) CuCl2
5) Fe(NO3)2
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
11. Установите соответствие между названием вещества и классом/группой, к которому(-й) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) трилинолеин | 1) алканы |
| Б) глицерин | 2) аминокислоты |
| В) кумол | 3) многоатомные спирты |
| 4) сложные эфиры | |
| 5) арены | |
| 6) простые эфиры |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, в молекуле каждого из которых хотя бы один атом углерода находится в sp3-гибридном состоянии.
1) дивинил
2) изопрен
3) стирол
4) толуол
5) формальдегид
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые могут быть в одну стадию получены из HC ≡ CNa.
1) пропин
2) этанол
3) бензоат натрия
4) ацетилен
5) метан
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, которые взаимодействуют как с гидроксидом натрия, так и с хлороводородом.
1) этиловый спирт
2) фенол
3) ацетат натрия
4) диметиловый эфир
5) акриловая кислота
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два реагента, которые взаимодействуют с глюкозой и с фруктозой образованием одного и того же продукта.
1) аммиачный раствор оксида серебра
2) свежеосажденный гидроксид меди
3) водород
4) вода
5) кислород
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между формулой алкана и реакцией, в результате которой этот алкан преимущественно образуется. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАКЦИЯ ПОЛУЧЕНИЯ |
| А) CH4 | 1) CH3CH2CH2COOK + KOH |
| Б) С2H6 | 2) CH3CH2COOK (электролиз раствора) |
| В) C3H8 | 3) KOOC — COOK + H2SO4 (конц) |
| Г) н-C4H10 | 4) CaC2 + H2O |
| 5) Al4C3 + H2O | |
| 6) CH3Br + Na |
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Установите соответствие между реагентами и органическим веществом, которое является продуктом реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) этилат натрия + вода | 1) бутират натрия |
| Б) метилат натрия + хлорэтан | 2) этанол |
| В) уксусный альдегид + гидроксид меди (II) | 3) этановая кислота |
| Г) масляная кислота + гидроксид натрия | 4) метанол |
| 5) этан | |
| 6) метилэтиловый эфир |
Запишите в поле ответа выбранные цифры в нужной последовательности.
18. Задана следующая последовательность превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) бромциклопентан
2) 1,2-дибромциклопентан
3) 1,4-дихлорциклопентан
4) циклопентанон
5) циклопентин
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все реакции гидратации.
1) C6H6 + 3H2 = C6H12
2) CH3CH=CH2 + H2 = CH3CH2CH3
3) CH3COH + H2O = CH3CH(OH)2
4) CaC2 + 2H2O = Ca(OH)2 + C2H2
5) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Запишите номера выбранных ответов.
20. Из предложенного перечня выберите все внешние воздействия, каждое из которых увеличивает скорость обеих реакций.
Сu + S = CuS и C6H5COOK + KOH = K2CO3 + C6H6
1) охлаждение реакционной смеси
2) добавление металла
3) увеличение площади поверхности соприкосновения реагентов
4) повышение температуры
5) повышение давления
Запишите номера выбранных веществ.
21. Установите соответствие между схемой окислительно-восстановительной реакции и элементом-окислителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОКИСЛИТЕЛЬ |
| А) 2KNO3 = 2KNO2 + O2 | 1) хлор |
| Б) (COOH)2 = CO2 + CO + H2O | 2) азот |
| В) CH4 + Cl2 = CH3Cl + HCl | 3) кислород |
| Г) NaClO2 = NaCl + O2 | 4) водород |
| 5) углерод |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые образуются на инертном катоде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА КАТОДЕ |
| А) Ba(NO3)2 | 1) H2 |
| Б) KSCN | 2) Металл |
| В) CH3CH2COONa | 3) Металл, Н2 |
| Г) Mg(NO3)2 | 4) O2 |
| 5) NO2, O2 | |
| 6) C4H10, CO2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ИОННОЕ УРАВНЕНИЕ ГИДРОЛИЗА |
| А) CuCl2 | 1) Rb+ + H2O ↔ RbOH + H+ |
| Б) RbF | 2) PO43− + 3H2O ↔ H3PO4 + 3OH− |
| В) K2HPO4 | 3) HPO42− + H2O ↔ H2PO4− + OH− |
| Г) K3PO4 | 4) Cu2+ + H2O ↔ CuOH+ + H+ |
| 5) F− + H2O ↔ HF + OH− | |
| 6) PO43– + H2O ↔ HPO42– + OH– |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему.
Fe3O4(тв) + 4СО(г) ↔ 3Fe(тв) + 4СО2(г) – Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление железа | 1) смещается в сторону реагентов |
| Б) повышение общего давления | 2) смещается в сторону продуктов |
| В) понижение температуры | 3) не происходит смещение равновесия |
| Г) измельчение железа |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить твердые вещества или их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) ВаСО3 и ВаSО4 | 1) HCl |
| Б) MgСl2 и MgSO4 | 2) BaCl2 |
| В) Al(NO3)3 и Mg(NO3)2 | 3) KOH |
| Г) Na3PO4 и NaCl | 4) H2O |
| 5) Сl2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между названием волокна и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВОЛОКНА | ТИП ВОЛОКНА |
| А) капрон | 1) полиэфирное |
| Б) лавсан | 2) полиамидное |
| В) нейлон | 3) элементоорганическое |
Запишите в поле ответа выбранные цифры в нужной последовательности.
| Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. |
27. Вычислите, какую массу (в граммах) хлорида натрия необходимо добавить в 100 г 4 %-ного раствора хлорида натрия, чтобы получить 20 %-ный раствор. (Запишите число с точностью до целых ).
28. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1840 кДж теплоты. Вычислите массу воды, в граммах, которая образовалась при этом. (Запишите число с точностью до целых. )
29. В раствор, содержащий избыток гидроксида натрия, добавили по каплям 50 г хлорида алюминия. Определите массу, в граммах, образовавшегося соединения алюминия. (Запишите число с точностью до десятых. )
Для выполнения заданий 30, 31 используйте следующий перечень веществ: хлорид железа (III), фторид калия, перманганат калия, аммиак, пероксид водорода, хлорид натрия. Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ. |
30. Из предложенного перечня веществ выберите вещества, в результате окислительно-восстановительной реакции между которыми восстановитель отдает два электрона на каждую молекулу. В ходе этой реакции наблюдается выделение газа, поддерживающего горение, и образование осадка. В ответе запишите уравнение окислительно-восстановительной реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
2KMnO4 + 3H2O2 = 2MnO2 + 3O2 + 2KOH + 2H2O
Mn+7 + 3e = Mn+4
2O− − 2e = O20
KMnO4 (Mn+7) — окислитель
H2O2 (O−) — восстановитель
31. Из предложенного перечня веществ выберите два вещества, при взаимодействии которых образуются две соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
FeCl3 + 3KF = FeF3 + 3KCl
Fe3+ + 3Cl– + 3K+ + 3F— = FeF3 + 3K+ + 3Cl–
Fe3+ + 3F— = FeF3
32. При обработке ацетата серебра раствором едкого натра выпал осадок, который растворили в нашатырном спирте. Полученный раствор взаимодействует с азотной кислотой с образованием двух солей, одна из которых разлагается при нагревании, не образуя сухого остатка. Напишите уравнения четырех описанных реакций.
2CH3COOAg + 2NaOH = Ag2O + 2CH3COONa + H2O
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
[Ag(NH3)2]OH + 3HNO3 = AgNO3 + 2NH4NO3 + H2O
NH4NO3 → N2O + 2H2O
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Навеску оксида меди массой 48 г нагрели в токе аммиака, твердый продукт реакции разделили на две равные части: первую перенесли в стакан, содержащий 100 г 40% раствора соляной кислоты, а вторую – в стакан со 100 г 96% серной кислоты. После окончания всех реакций масса одного из стаканов стала больше массы другого на 12,8 грамма. Найдите выход реакции восстановления оксида меди.
3CuO + 2NH3 = 3Cu + N2 + 3H2O (1)
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
Cu + 2H2SO4 = CuSO4 + H2O + SO2
n(CuO) = 48/80 = 0,6 моль
Пусть в реакцию(1) вступило х моль аммиака, тогда:
n(NH3) = x моль
n1(CuO) = 1,5х моль
При этом образовалось:
n(Cu) = 1,5х моль
В конечной смеси присутствуют:
n(Cu) = 1,5х моль, nост. (CuO) = 0,6 — 1,5х моль
(CuO) = 0,6 — 1,5х моль
Если смесь разделили на равные части, то в первой части присутствуют:
n1(Cu) = 0,75х моль, n1(CuO) = 0,3 — 0,75х моль
m1(CuO) = 80*(0,3 — 0,75х) г = (24-60х) г
m1(Cu) = 64* 0,75х г = 48х г
В первом стакане протекает реакция:
CuO + 2HCl = CuCl2 + H2O
Масса конечного раствора в первом стакане:
m1,р-ра = 100 + (24 — 60х) = 124 — 60х г
Но! Масса всего содержимого первого стакана:
m1,ст = 100 + (24 — 60х) + 48х = 124 — 12х г
Во втором стакане протекают реакции:
CuO + H2SO4 = CuSO4 + H2O
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
n2(Cu) = 0,75х моль, n2(CuO) = 0,3 — 0,75х моль
m2(CuO) = 80*(0,3 — 0,75х) г = (24 — 60х) г
m1(Cu) = 64* 0,75х г = 48х г
n2(SO2) = 0,75х моль, m2(SO2) = 64*0,75х = 48x г,
Масса конечного раствора во втором стакане:
m2,ст = 100 + (24 — 60х) + 48х — 48х = 124 — 60х г
Получаем уравнение:
m1,ст — m2,ст = 12,8 г
124 — 12х — 124 + 60х = 12,8
48х = 12,8
x = 0,267 моль
Тогда в реакцию вступило:
n(CuO) = 1,5*0,267 = 0,4 моль
Выход реакции:
η = 0,4/0,6 = 0,667 или 66,7%
Ответ: 66,7%
35. Массовые доли углерода и кислорода в молекуле органического вещества равны соответственно 40,00% и 53,33%. Известно, что это вещество можно получить в одну стадию из глюкозы.
Массовые доли углерода и кислорода в молекуле органического вещества равны соответственно 40,00% и 53,33%. Известно, что это вещество можно получить в одну стадию из глюкозы.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу исходного органического вещества, однозначно отражающую порядок связи атомов в молекуле;
4) напишите уравнение реакции взаимодействия этого вещества с подкисленным раствором перманганата калия.
Открытый вариант ЕГЭ по химии-2021 ФИПИ
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1) S 2) V 3) Mg 4) Al 5) H |
1. Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите в поле ответа номера выбранных элементов.
Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку и содержат ковалентные неполярные связи.
1) оксид меди(II)
2) оксид углерода(II)
3) пропан
4) белый фосфор
5) гидроксид натрия
Запишите номера выбранных ответов.
5. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) NaHSO3 | 1) пероксиды |
| Б) Na2O2 | 2) кислые соли |
| В) Na2ZnO2 | 3) средние соли |
| 4) основные оксиды |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует графит.
1) соляная кислота
2) серная кислота (конц.)
3) сульфат магния
4) водород
5) гидроксид калия (р-р)
Запишите номера выбранных ответов.
7. В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфат алюминия
2) нитрат магния
3) фтороводородная кислота
4) силикат калия
5) гидроксид цинка
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Cu | 1) H2SiO3, CrCl3, K2SO4 |
| Б) CuO | 2) H2SO4 (p-p), HNO3 (конц. ), HCl (р-р) ), HCl (р-р) |
| В) Fe(OH)3 | 3) H2SO4 (конц.), HNO3 (p-p), O2 |
| Г) NH4Cl | 4) AgNO3, Ba(OH)2, KOH |
| 5) CH4, KMnO4, NaH |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Установите соответствие между реагирующими веществами и продуктом(-ами), который(-е) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) CO2 и Сa(OH)2 (изб.) | 1) FeI2 и K2SO4 |
| Б) Fe2(SO4)3 и KI (p-p) | 2) Fe(OH)3, K2SO4 и HI |
В) CO2 (изб. ) и Сa(OH)2 ) и Сa(OH)2 | 3) CaCO3 и H2O |
| Г) Ca(HCO3)2 и Сa(OH)2 | 4) CaCO3, CO2 и H2O |
| 5) Ca(HCO3)2 | |
| 6) FeI2, I2 и K2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) HI
2) KIO3
3) NaBr
4) NaI
5) I2
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
11. Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) анилин | 1) аминокислоты |
| Б) аланин | 2) кетоны |
| В) ацетон | 3) амины |
| 4) спирты |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
1) 1,1-дибромэтен
2) бутен-1
3) 2,3-дибромпропен
4) 1,2-дибромэтен
5) бутен-2
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с избытком раствора брома образуется вещество состава C4H8Br2.
1) 2-метилбутен-1
2) метилпропен
3) бутадиен-1,3
4) бутин-1
5) метилциклопропан
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, которые могут взаимодействовать с водородом.
1) этанол
2) этиленгликоль
3) формальдегид
4) глицерин
5) фенол
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота.
1) соляная кислота
2) метан
3) гидроксид натрия
4) бензол
5) медь
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между схемой реакции и органическим продуктом, который преимущественно образуется в результате этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
| А) CH3C≡CH + H2O (Hg2+) → | 1) пропан |
| Б) CH3CHClCH2Cl + Zn → | 2) пропанон |
В) CH3CCl2CH3 + NaOH(водн. ) → ) → | 3) пропанол-1 |
| Г) CH3CH2CH2Cl + NaOH(водн.) → | 4) пропанол-2 |
| 5) пропен | |
| 6) пропаналь |
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Установите соответствие между веществом и продуктом реакции этого вещества с бромоводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТ РЕАКЦИИ |
| А) этиленгликоль | 1) аминоуксусная кислота |
| Б) ацетат аммония | 2) ацетон |
| В) изопропанол | 3) 2-бромпропан |
| Г) этилат натрия | 4) этанол |
| 5) 1,2-дибромэтан | |
| 6) уксусная кислота |
Запишите в поле ответа выбранные цифры в нужной последовательности.
18. Задана следующая последовательность превращений веществ:
CH4 → X → Y → C6H12
Определите, какие из указанных веществ являются веществами Х и Y.
1) бензол
2) этан
3) толуол
4) ацетилен
5) хлорметан
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации.
1) серная кислота
2) оксид серы(VI)
3) сероводород
4) сульфат магния
5) сульфат аммония
Запишите номера выбранных ответов.
20. Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления.
1) оксид магния
2) оксид серы(IV)
3) медь
4) сероводород
5) фосфин
Запишите в поле ответа номера выбранных воздействий.
21. Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 | 1) +4 → +5 |
| Б) 2NH3 + 3CuO = N2 + 3Cu + 3H2O | 2) –3 → 0 |
| В) 3NO2 + H2O = 2HNO3 + NO | 3) –2 → 0 |
| 4) –3 → +2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) Ca(NO3)2 | 1) металл, водород, кислород |
| Б) Li2SO4 | 2) водород, кислород |
| В) BaCl2 | 3) металл, водород, галоген |
| Г) AgNO3 | 4) металл, галоген |
| 5) водород, галоген | |
| 6) металл, кислород |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) Hg(NO3)2 | 1) кислая |
| Б) NaNO3 | 2) нейтральная |
| В) Na3PO4 | 3) щелочная |
| Г) AuCl3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему
CH3CH2COOCH(CH3)2(ж) + H2O(ж) ←→ CH3CH2COOH(ж) + (CH3)2CHOH(ж) − Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры | 1) смещается в сторону прямой реакции |
| Б) добавление твёрдой щёлочи | 2) смещается в сторону обратной реакции |
| В) добавление воды | 3) практически не смещается |
| Г) понижение давления |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) уксусная кислота и этанол | 1) Br2 (водн.) |
| Б) бутин-1 и бутин-2 | 2) лакмус |
| В) метан и пропилен | 3) фенолфталеин |
| Г) этилен и ацетилен | 4) Ag2O (NH3 р-р) |
| 5) KCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) анилин | 1) в качестве моторного топлива |
| Б) ацетилен | 2) газовая сварка металлов |
| В) толуол | 3) в качестве растворителя |
| 4) производство красителей и лекарств |
Запишите в поле ответа выбранные цифры в нужной последовательности.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответа указывать не нужно. При проведении расчётов для всех элементов, кроме хлора, используйте значения относительных атомных масс, выраженные целыми числами (Ar(Cl) = 35,5).
27. Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
28. Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции
NH4NO2(кр.) = N2(г) + 2H2O(г) + 316 кДж.
(Запишите число с точностью до десятых.)
29. Вычислите объём (в литрах при н. у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
| Для выполнения заданий 30, 31 используйте следующий перечень веществ: уксусная кислота, сульфат лития, перманганат натрия, карбонат натрия, серная кислота, иодид магния. Допустимо использование водных растворов веществ. |
30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и солей. Запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
5MgI2 + 2NaMnO4 + 8H2SO4 = 5MgSO4 + Na2SO4 + 2MnSO4 + 5I2 + 8H2O
2I–1 − 2𝑒̅ = I2 |5
Mn+7 + 5𝑒̅ = Mn+2 |2
MgI2 (I–1) – восстановитель, NaMnO4 (Mn+7) – окислитель.
31. Из предложенного перечня выберите сильный и слабый электролиты, между которыми возможна реакция ионного обмена, протекающая с образованием газа. Запишите молекулярное, полное и сокращённое ионные уравнения только одной возможной реакции.
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 + H2O
2Na+ + CO32– + 2CH3COOH = 2Na+ + 2CH3COO– + CO2 + H2O
CO32– + 2CH3COOH = 2CH3COO– + CO2 + H2O
32. Серу растворили в концентрированной азотной кислоте при нагревании. Выделившийся при этом бурый газ пропустили над нагретым порошком меди. Полученное твёрдое вещество растворили в соляной кислоте. Затем к образовавшемуся раствору добавили иодоводородную кислоту, при этом наблюдали образование осадка и изменение цвета раствора. Напишите уравнения четырёх описанных реакций.
Напишите уравнения четырёх описанных реакций.
1. S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
2. 2NO2 + 4Cu = 4CuO + N2
3. CuO + 2HCl = CuCl2 + H2O
4. 2CuCl2 + 4НI = 2CuI + I2 + 4НCl
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
1. Запишем уравнения реакций:
(1) Сa(NO3)2 = Ca(NO2)2 + O2
(2) 2Ca(NO3)2 = 2CaO + 4NO2 + O2
(3) 4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2. Масса исходного гидроксида калия
m(KOH) = mр-ра · ω (KOH) = 133,6 · 0,4 = 53,44 г
3. Вычислим количества вещества газов в реакции (2)
Пусть n2(O2) = x моль, тогда n2(NO2) = 4x моль
В реакцию (3) кислород и оксид азота (IV) вступают в таком же соотношении, следовательно:
n3(O2) = x моль, тогда n3(NO2) = 4x моль
m3(O2) = 32x г, тогда m3(NO2) = 4x · 46 = 184х г
При этом в реакцию вступило:
nпрореаг. (KOH) = 4х моль
(KOH) = 4х моль
mпрореаг.(KOH) = 4х·56 = 224х г
mост.(KOH) = 53,44 — 224х г
Масса конечного раствора:
mр-ра = 133,6 + 32х + 184х = 133,6 + 216х
Получаем выражение:
ω2(KOH) = mост.(KOH) / mр-ра ·
0,2 = (53,44 – 224x) / (133,6 + 216х)
x = 0,1 моль
n2(O2) = 0,1 моль, n2(NO2) = 0,4 моль
Следовательно, в реакцию (2) вступило:
n2(Сa(NO3)2) = 0,2 моль
По условию:
V1(O2) : V2(исх. смеси газов) = n1(O2) : (n1(O2) + n2(O2) + n2(NO2)) = 1 : 2
Отсюда n1(O2) = 0,5 моль
n1(Сa(NO3)2) = 0,5 моль
nобщ.(Сa(NO3)2) = 0,5 + 0,2 = 0,7 моль
mобщ. (Сa(NO3)2) = n · M = 0,7 · 164 = 114,8 г
(Сa(NO3)2) = n · M = 0,7 · 164 = 114,8 г
35. При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода. Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества А — в sp3-гибридизации. На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
1. Общая формула вещества СxHyСlzOt
n(CO2) = V : VM = 20,16 : 22,4 = 0,9 моль= n(C)
n(HCl) = V : VM = 20,16 : 22,4 = 0,9 моль= n(Cl) = n(H)
m(O) = 43,65 – 12 · 0,9 – 1 · 0,9 – 35,5 · 0,9 = 0
𝑥 ∶ 𝑦 ∶ 𝑧 = 0,9 ∶ 0,9 ∶ 0,9 = 1 ∶ 1 ∶ 1 = 6 ∶ 6 ∶ 6
Молекулярная формула С6H6Cl6
2. Структурная формула
Структурная формула
3. Уравнение реакции
Решу егэ химия статград. Тесты по химии егэ онлайн. Структура экзаменационной работы состоит из двух блоков
За 2-3 месяца невозможно выучить (повторить, подтянуть) такую сложную дисциплину, как химия.
Изменений в КИМ ЕГЭ 2020 г. по химии нет.
Не откладывайте подготовку на потом.
- Приступив к разбору заданий сначала изучите теорию . Теория на сайте представлена для каждого задания в виде рекомендаций, что необходимо знать при выполнении задания. направит в изучении основных тем и определяет какие знания и умения потребуются при выполнении заданий ЕГЭ по химии. Для успешной сдачи ЕГЭ по химии – теория важнее всего.
- Теорию нужно подкреплять практикой , постоянно решая задания. Так как большинство ошибок из-за того, что неправильно прочитал упражнение, не понял, что требуют в задаче. Чем чаще ты будешь решать тематические тесты, тем быстрее поймёшь структуру экзамена.
 Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.
Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.
Баллы за каждое задание по химии
- 1 балл — за 1-6, 11-15, 19-21, 26-28 задания.
- 2 балла — 7-10, 16-18, 22-25, 30, 31.
- З балла — 35.
- 4 балла — 32, 34.
- 5 баллов — 33.
Всего: 60 баллов.
Структура экзаменационной работы состоит из двух блоков:- Вопросы, предполагающие краткий ответ (в виде цифры или слова) – задания 1-29.
- Задачи с развернутыми ответами – задания 30-35.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
На экзамене будет три шпаргалки. И в них нужно разбираться
Это 70% информации, которая поможет успешно сдать экзамен по химии. Остальные 30% — умение пользоваться представленными шпаргалками.
- Если хочешь получить больше 90 баллов, нужно тратить на химию очень много времени.

- Чтобы сдать успешно ЕГЭ по химии, нужно много решать: , тренировочных заданий, даже если они покажутся легкими и однотипными.
- Правильно распределять свои силы и не забывать об отдыхе.
Дерзайте, старайтесь и всё у вас получится!
Разработали тренировочные тесты по химии для ЕГЭ 2020 с ответами и решениями.
При подготовке изучите 10 тренировочных вариантов, составленные на основе новой демоверсии .
Особенности заданий в тестах ЕГЭ по химии
Рассмотрим типологию и структуру некоторых заданий первой части:
- – в условии дан ряд химических элементов и вопросы касательно каждого из них, обратите внимание на количество клеточек для ответа – их две, следовательно, и вариантов решения два;
- – соответствие между двумя множествами: будут два столбца, в одном формулы веществ, а во втором – группа веществ, необходимо будет найти соответствия.
- В первой части будут еще и задачи, требующие поведения «мысленного химического эксперимента», при котором ученик выбирает формулы, позволяющие найти правильный ответ на экзаменационный вопрос.

- Задачи второго блока выше по уровню сложности и требуют владения несколькими элементами содержания и несколькими навыками и умениями.
Подсказка : при решении задачи важно определить класс, группу вещества и свойства.
Задания с развернутыми ответами ориентированы на проверку знаний по основным курсам:
Подготовка к ЕГЭ по химии – быстро и качественно
Быстро – значит, не менее, чем за полгода:
- Подтянуть математику.
- Повторить всю теорию.
- Решать онлайн пробные варианты по химии, смотреть видеоуроки.
Наш сайт предусмотрел такую возможность – заходи тренируйся и получай высокие баллы на экзаменах.
Советы для подготовки к ЕГЭ по химии на сайте сайт
Как грамотно сдать ЕГЭ (и ОГЭ) по химии? Если времени всего 2 месяца, а вы еще и не готовы? Да и с химией не дружите…
Предлагает тесты с ответами по каждой теме и заданию, проходя которые вы можете изучит основные принципы, закономерности и теорию встречающуюся в ЕГЭ по химии. Наши позволяют найти ответы на большинство вопросов встречающихся в ЕГЭ по химии, а наши тесты позволяют закрепить материал, найти слабые места, и отработать материал.
Наши позволяют найти ответы на большинство вопросов встречающихся в ЕГЭ по химии, а наши тесты позволяют закрепить материал, найти слабые места, и отработать материал.
Все, что вам нужно — это интернет, канцтовары, время и сайт. Лучше всего завести отдельную тетрадь для формул/решений/пометок и словарик тривиальных названий соединений.
- С самого начала нужно оценить свой текущий уровень и то количество баллов, которое вам необходимо, для этого стоит пройти . Если всё очень плохо, а нужны отличные показатели — поздравляю, даже сейчас еще не всё потеряно. Надрессировать себя на успешную сдачу можно успеть и без помощи репетитора.
Определитесь с минимальным количеством балов, которое вы хотите набрать, это позволит вам понять сколько заданий вы должны решить точно, чтобы получить необходимый вам балл.
Естественно учитывайте, что всё может пойти не так гладко и решайте как можно большее число задач, а лучше по все. Тот минимум, что вы определили для себя — вы должны решать идеально.
- Перейдем к практической части -дрессировке на решение.
Самый эффективный способ — следующий. Выбираете только интересующего вас экзамена и решаете соответствующий тест. Около 20 решенных заданий гарантируют встречу всех типов задач. Как только начинаете чувствовать, что каждое увиденное вами задание вы знаете как решать от начала и до конца – приступайте к следующему заданию. Если не знаете, как решать какое-либо задание — воспользуйтесь поиском по нашему сайту. Решение на нашем сайте есть практически всегда, в ином случае просто напишите репетитору, кликнув на значок в левом нижнем углу – это бесплатно. - Параллельно повторяем третий пункт для всех у нас на сайте, начиная с .
- Когда первая часть дается вам хотя бы на среднем уровне — начинаете решать . Если одно из заданий плохо поддается, и вы ошиблись в его выполнении то возвращаетесь к тестам по этому заданию или соответствующей теме с тестами.
- Часть 2. Если у вас есть репетитор — сосредоточьтесь с ним на изучении этой части.
 (при условии того, что вы в состоянии решить остальное хотя бы в 70%). Если вы начали часть 2, то проходной балл вы должны набирать без какого-либо проблем в 100% случаев. Если этого не происходит, лучше пока оставаться на первой части. Когда вы будете готовы к части 2, рекомендуем обзавестись отдельной тетрадкой, где вы будете записывать только решения части 2. Залог успеха это нарешивание как можно большего объема заданий как и в части 1.
(при условии того, что вы в состоянии решить остальное хотя бы в 70%). Если вы начали часть 2, то проходной балл вы должны набирать без какого-либо проблем в 100% случаев. Если этого не происходит, лучше пока оставаться на первой части. Когда вы будете готовы к части 2, рекомендуем обзавестись отдельной тетрадкой, где вы будете записывать только решения части 2. Залог успеха это нарешивание как можно большего объема заданий как и в части 1.
ЕГЭ по химии – экзамен, который сдают выпускники, планирующие поступать в ВУЗ на определенные специальности, связанные с данной дисциплиной. Химия не входит в перечень обязательных предметов, по статистике, из 10 выпускников химию сдает 1.
- На тестирование и выполнение всех заданий выпускник получает 3 часа времени – планирование и распределение времени на работу со всеми заданиям является важной задачей испытуемого.
- Обычно экзамен включает 35-40 заданий, которые делятся на 2 логических блока.
- Как и остальные ЕГЭ, испытание по химии делится на 2 логических блока: тестирование (выбор правильного варианта или вариантов из предложенных) и вопросы, на которые требуется дать развернутые ответы.
 Именно второй блок обычно занимает больше времени, поэтому испытуемому необходимо рационально распределять время.
Именно второй блок обычно занимает больше времени, поэтому испытуемому необходимо рационально распределять время.
- Главное – иметь надежные, глубокие теоретические знания, которые помогут успешно выполнять различные задания первого и второго блоков.
- Готовиться нужно начинать заранее, чтобы систематически проработать все темы – полугода может быть мало. Лучший вариант – начать подготовку еще в 10-ом классе.
- Определите темы, которые составляют для вас наибольшие проблемы, чтобы, обращаясь за помощью к учителю или репетитору, знать, что спрашивать.
- Учиться выполнять задания, типичные для ЕГЭ по химии – мало владеть теорией, необходимо довести навыки выполнения задач и различных заданий до автоматизма.
- Не всегда самостоятельная подготовка эффективна, поэтому стоит найти специалиста, к которому вы сможете обратиться за помощью. Лучший вариант – профессиональный репетитор. Также не стоит бояться задавать вопросы школьному учителю.
 Не пренебрегайте школьным образованием, внимательно выполняйте задания на уроках!
Не пренебрегайте школьным образованием, внимательно выполняйте задания на уроках! - На экзамене есть подсказки! Главное – научиться пользоваться этими источниками информации. Ученик располагает таблицей Менделеева, таблицами напряжения металлов и растворимости – это около 70% данных, которые помогут разобраться в различных заданиях.
- Химия требует основательных знаний в математике – без этого будет трудно решать задачи. Обязательно повторите работу с процентами и пропорциями.
- Выучите формулы, которые необходимы для решения задач по химии.
- Изучите теорию: пригодятся учебники, справочники, сборники задач.
- Оптимальный способ закрепить теоретические задания – активно решать задания по химии. В онлайн режиме вы можете решать в любом количестве, совершенствовать навыки решения задач разного типа и уровня сложности.

- Спорные моменты в заданиях и ошибки рекомендуется разбирать и анализировать при помощи учителя или репетитора.
Химия | ЕГЭ 2018
Пройти тест «ЕГЭ 2018 Химия Тренировочный вариант №3» онлайн
Химия | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по химии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по химии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 Химия Тренировочный вариант №4» онлайн
Химия | ЕГЭ 2018
Решение теста ЕГЭ 2018 по химии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по химии соответствует демоварианту 2018 года.
Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по химии соответствует демоварианту 2018 года.
Пройти тест «Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2018 года по ГЕОГРАФИИ» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ по географии знакомит школьников с заданиями демоварианта ЕГЭ 2018 года ФИПИ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №1» онлайн
География | ЕГЭ 2018
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №2» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №3» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №4» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №5» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №6» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №7» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №8» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №9» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «ЕГЭ 2018 География Тренировочный вариант №10» онлайн
География | ЕГЭ 2018
Решение онлайн-теста ЕГЭ 2018 по географии знакомит школьников с заданиями настоящего ЕГЭ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся. Тренировочный вариант ЕГЭ по географии соответствует демоварианту 2018 года.
Пройти тест «Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2018 года по ИСТОРИИ» онлайн
История | ЕГЭ 2018
Решение онлайн-теста ЕГЭ по истории знакомит школьников с заданиями демоварианта ЕГЭ 2018 года ФИПИ и помогает овладеть необходимыми навыками решения заданий КИМ. Учителя могут использовать онлайн-тестирование бесплатно на уроках для тренировки и контроля учащихся.
21.09.2021. Тренировочная работа №1 по химии 11 класс (ХИ2110101-04) задания и ответы
Описание
Некоторые задания:
1. Определите, какие из указанных элементов имеют на внешнем уровне больше s-электронов, чем p-электронов (в основном состоянии)? Запишите номера выбранных элементов.
Определите, какие из указанных элементов имеют на внешнем уровне больше s-электронов, чем p-электронов (в основном состоянии)? Запишите номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы их в порядке увеличения их электро-отрицательности. Запишите номера выбранных элементов в нужной последовательности.
3. Из указанного ряда выберите два элемента, которые в соединениях могут проявлять степень окисления +6.
Запишите номера выбранных элементов.
4. Из предложенного перечня выберите два вещества ионного строения, в которых нет ковалентных связей.
1) Nh5Cl
2) Li2O
3) NaNO3
4) h3O2
5) BaBr2
6. В двух пробирках находился порошок серы. В первую пробирку добавили концентрированный раствор вещества Х, и пробирку нагревали до завершения реакции, во вторую пробирку прилили концентрированный раствор вещества Y. В обеих пробирках порошок растворился, но в первой пробирке газ выделился, а во второй – нет. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) h3S
2) Na2SO3
3) h3SO4
4) Nh4
5) HCl
11. Из предложенного перечня выберите два вещества, в составе которых только один атом углерода находится в sp2-гибридном состоянии.
1) пропен
2) бензол
3) пропаналь
4) этилацетат
5) бутин-1
13. Из предложенного перечня выберите два углевода, которые реагируют с аммиачным раствором оксида серебра.
1) целлюлоза
2) мальтоза
3) рибоза
4) фруктоза
5) сахароза
17. Из предложенного перечня выберите все реакции, которые являются окислительно-восстановительными.
1) взаимодействие бромида натрия с фосфорной кислотой при нагревании
2) взаимодействие бромида натрия с концентрированной серной кислотой
3) взаимодействие дихромата аммония с раствором гидроксида калия
4) растворение кремния в растворе гидроксида калия
5) прокаливание нитрата натрия со свинцом
Химия – CLEP | Совет колледжа
Обзор
Экзамен по химии охватывает материал, который обычно преподается на годичных курсах общей химии в колледже. Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Научный калькулятор
Научный (неграфический) калькулятор TI-30XS MultiView™ интегрирован в экзаменационное программное обеспечение и доступен учащимся в течение всего времени тестирования.
Чтобы использовать калькулятор во время экзамена, учащиеся должны выбрать значок Calculator . Информация о том, как использовать калькулятор, доступна на значке Help на вкладке Calculator . Ожидается, что учащиеся будут знать, как и когда правильно использовать калькулятор.
Посетите ETS, чтобы узнать больше и попрактиковаться в использовании инженерного калькулятора. Онлайн-калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Онлайн-калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Периодическая таблица
Чтобы использовать Периодическую таблицу элементов во время экзамена, выберите значок Справка в меню в верхней части экрана, а затем выберите вкладку Периодическая таблица .
Необходимые знания и навыки
Экзамен содержит примерно 75 вопросов, на которые нужно ответить за 90 минут.Некоторые из них являются предварительными вопросами, которые не будут оцениваться.
Вопросы на экзамене по химии требуют от кандидатов демонстрации одной или нескольких из следующих способностей:
- Вспомнить: запомнить конкретные факты; продемонстрировать простое знание информации и знакомство с терминологией
- Применение: понимать концепции и переформулировать информацию в другие эквивалентные термины; применять знания в незнакомых и/или практических ситуациях; использовать математику для решения задач по химии
- Интерпретация: вывод и вывод из имеющихся данных и объединение информации для формирования выводов; признавать невысказанные допущения
Предмет экзамена по химии состоит из следующих тем. Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Структура материи (20%)
Теория атома и строение атома
- Доказательства атомной теории
- Атомные массы; определение химическими и физическими средствами
- Атомный номер и массовое число; изотопы и масс-спектроскопия
- Энергетические уровни электронов: атомные спектры и атомные орбитали
- Периодические соотношения, включая, например, атомные радиусы, энергии ионизации, сродство к электрону и степени окисления
- Ядерная химия: ядерные уравнения, периоды полураспада и радиоактивность; химическое применение
Химическое соединение
- Связующие силы
- Типы: ковалентная, ионная, металлическая, макромолекулярная (или сетчатая), дисперсионная и с водородной связью
- Отношения к структуре и свойствам
- Полярность связей и электроотрицательность
- Теория VSEPR и электронно-точечные диаграммы Льюиса
- Гибридизация орбиталей
- Геометрия молекул, ионов и координационных комплексов
- Структурная изомерия
- Резонанс
- Сигма- и пи-облигации
- Дипольные моменты молекул
- Связь свойств со структурой
Состояние вещества (19%)
Газы
- Законы идеальных газов; уравнения состояния идеального газа
- Концепция крота; Номер Авогадро
- Кинетико-молекулярная теория
- Интерпретация законов идеального газа на основе этой теории
- Зависимость кинетической энергии молекул от температуры: распределение Больцмана
- Отклонения от законов идеальных газов
Жидкости и твердые вещества
- Жидкости и твердые вещества с кинетической молекулярной точки зрения
- Фазовые диаграммы однокомпонентных систем
- Изменения состояния и критические явления
Решения
- Типы растворов и факторы, влияющие на растворимость
- Методы выражения концентрации
- Коллигативные свойства; например, закон Рауля
- Влияние межионного притяжения на коллигативные свойства и растворимость
Типы реакций (12%)
Кислотно-основные реакции; концепции Аррениуса, Бренстеда-Лоури и Льюиса; амфотеризм
Реакции с участием координационных комплексов
Реакции осаждения
Окислительно-восстановительные реакции
- Номер окисления
- Роль электрона в окислительно-восстановительных процессах
- Электрохимия; электролитические ячейки, стандартные потенциалы полуячейки, предсказание направления окислительно-восстановительных реакций и влияние изменения концентрации
Уравнения и стехиометрия (10%)
Ионные и молекулярные частицы, присутствующие в химических системах; сетевые ионные уравнения
Стехиометрия: соотношение массы и объема с упором на концепцию моля
Баланс уравнений, в том числе для окислительно-восстановительных реакций
Равновесие (7%)
Концепция динамического равновесия физических и химических веществ; принцип ЛеШателье; константы равновесия
Количественная обработка
- Константы равновесия для газовых реакций с точки зрения как молярных концентраций, так и парциального давления (K c , K p )
- Константы равновесия для реакций в растворах
- Константы для кислот и оснований; рК; рН
- Константы произведения растворимости и их применение для осаждения и растворения малорастворимых соединений
- Константы для комплексных ионов
- Общий ионный эффект; буферы
Кинетика (4%)
Понятие скорости реакции
- Порядок реакции и константа скорости
- Определение порядка реакции и константы скорости по экспериментальным данным
- Влияние изменения температуры на скорость
Энергия активации и роль катализаторов
Взаимосвязь между определяющей скорость стадией и механизмом реакции
Термодинамика (5%)
Государственные функции
Первый закон:
- Теплота образования
- Теплота реакции, изменение энтальпии и закон Гесса
- Теплоемкость; теплоты парообразования и плавления
Второй закон:
- Свободная энергия образования
- Свободная энергия реакции
- Зависимость изменения свободной энергии от изменения энтальпии и энтропии
Зависимость изменения свободной энергии от констант равновесия и электродных потенциалов
Описательная химия (14%)
Накопление определенных фактов по химии необходимо для того, чтобы учащиеся могли:
- понимать развитие принципов и концепций
- продемонстрировать применение принципов
- связать факты с теорией и свойства со структурой
- развивать понимание систематической номенклатуры, которая облегчает общение
Следующие области обычно включаются в экзамен:
- Химическая активность и продукты химических реакций
- Отношения в периодической таблице: горизонтальные, вертикальные и диагональные
- Химия основных групп и переходных элементов, включая типичные примеры каждой
- Органическая химия, включая такие темы, как функциональные группы и изомерия (может рассматриваться как отдельная единица или как пример материала в других областях, таких как связывание)
Экспериментальная химия (9%)
Некоторые вопросы основаны на лабораторных экспериментах, широко проводимых в области общей химии, и касаются используемого оборудования, проведенных наблюдений, выполненных расчетов и интерпретации результатов. Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Предметный тест по химии GRE (для сдающих тест)
Обзор
- Тест состоит примерно из 130 вопросов с несколькими вариантами ответов.
- Периодическая таблица напечатана в тестовом буклете, а также таблица с информацией, представляющей различные физические константы и несколько коэффициентов пересчета единиц СИ.При необходимости вместе с текстом вопроса печатаются дополнительные значения физических констант.
- Тестовые вопросы созданы для упрощения математических манипуляций. В результате не нужны ни калькуляторы, ни таблицы логарифмов. Если решение задачи требует использования логарифмов, необходимые значения включаются в вопрос.
- Содержание теста подчеркивает четыре области, на которые химия традиционно делится, и некоторые взаимосвязи между областями.
 Из-за этих взаимосвязей отдельные вопросы могут проверять более чем одну область химии.
Из-за этих взаимосвязей отдельные вопросы могут проверять более чем одну область химии. - Некоторые испытуемые могут связать конкретный вопрос с одним полем, в то время как другие испытуемые могут столкнуться с тем же материалом в другом поле. Например, знания, необходимые для ответа на некоторые вопросы, классифицируемые как тестирование органической химии, вполне могли быть получены некоторыми тестируемыми на курсах аналитической химии.
- Следовательно, акценты четырех областей, указанных в следующем плане материала, охватываемого тестом, не следует считать окончательными.
Спецификации содержимого
I. АНАЛИТИЧЕСКАЯ ХИМИЯ — 15%
- Сбор данных и использование статистики. Ошибки, статистические соображения
- Решения и стандартизация. Условия концентрации, первичные стандарты
- Гомогенные равновесия. Кислотно-основное, окислительно-восстановительное, комплексометрия
- Гетерогенные равновесия. Гравиметрический анализ, растворимость, осадочное титрование, химическое разделение
- Инструментальные методы.
 Электрохимические методы, спектроскопические методы, хроматографические методы, термические методы, калибровка приборов
Электрохимические методы, спектроскопические методы, хроматографические методы, термические методы, калибровка приборов - Экологические приложения
- Радиохимические методы. Детекторы, приложения
II.НЕОРГАНИЧЕСКАЯ ХИМИЯ — 25%
- Общая химия. Периодические тенденции, степени окисления, ядерная химия
- Ионные вещества. Геометрия решетки, энергия решетки, ионные радиусы и эффекты радиус/отношение
- Ковалентные молекулярные вещества — диаграммы Льюиса, молекулярные точечные группы, концепция VSEPR, описание и гибридизация валентных связей, описание молекулярных орбиталей, энергии связи, ковалентные и ван-дер-ваальсовы радиусы элементов, межмолекулярные силы
- Металлы и полупроводники. Структура, зонная теория, физические и химические следствия зонной теории
- Концепции кислот и оснований — подходы Бренстеда-Лоури, теория Льюиса, подходы системы растворителей
- Химия элементов основной группы. Электронное строение, возникновение и восстановление, физические и химические свойства элементов и их соединений
- Химия переходных элементов.
 Электронное строение, возникновение и восстановление, физические и химические свойства элементов и их соединений, координационная химия
Электронное строение, возникновение и восстановление, физические и химические свойства элементов и их соединений, координационная химия - Специальные темы — Металлоорганическая химия, катализ, бионеорганическая химия, прикладная химия твердого тела, химия окружающей среды
III.ОРГАНИЧЕСКАЯ ХИМИЯ — 30%
- Структура, связывание и номенклатура — структуры Льюиса, орбитальная гибридизация, конфигурация и стереохимическое обозначение, конформационный анализ, систематическая номенклатура IUPAC, спектроскопия (ИК и 1 H и 13 C ЯМР)
- Функциональные группы. Получение, реакции и взаимопревращения алканов, алкенов, алкинов, диенов, алкилгалогенидов, спиртов, простых эфиров, эпоксидов, сульфидов, тиолов, ароматических соединений, альдегидов, кетонов, карбоновых кислот и их производных, аминов
- Механизмы реакций. Нуклеофильные замещения и присоединения, нуклеофильные ароматические замещения, электрофильные присоединения, электрофильные ароматические замещения, отщепления, реакции Дильса-Альдера и другие циклоприсоединения
- Реактивные промежуточные соединения.
 Химия и природа карбокатионов, карбанионов, свободных радикалов, карбенов, бензинов, енолов
Химия и природа карбокатионов, карбанионов, свободных радикалов, карбенов, бензинов, енолов - Металлоорганические соединения. Получение и превращение реактивов Гриньяра и литийорганических реагентов, литиевых органокупратов и других современных основных групп и реагентов и катализаторов на основе переходных металлов
- Специальные темы — резонанс, теория молекулярных орбиталей, катализ, кислотно-основная теория, углеродная кислотность, ароматичность, антиароматичность, макромолекулы, липиды, аминокислоты, пептиды, углеводы, нуклеиновые кислоты, терпены, асимметричный синтез, орбитальная симметрия, полимеры
IV.ФИЗИЧЕСКАЯ ХИМИЯ — 30%
- Термодинамика. Первый, второй и третий законы, термохимия, идеальные и реальные газы и растворы, энергия Гиббса и Гельмгольца, химический потенциал, химические равновесия, фазовые равновесия, коллигативные свойства, статистическая термодинамика
- Квантовая химия и приложения к спектроскопии. Классические эксперименты, принципы квантовой механики, строение атомов и молекул, молекулярная спектроскопия
- Динамика — Экспериментальная и теоретическая химическая кинетика, динамика растворов и жидкостей, фотохимия
Загрузить учебное пособие
Назад к тестовому содержимому
Вступительный экзамен по химии | Химический факультет
Описание
Вступительный экзамен по химии (CPE) – это онлайн инструмент, с помощью которого учащиеся направляются на курс общей химии, соответствующий их уровню подготовки. Учащиеся с достаточным уровнем подготовки по химии, на что указывает «проходной» балл на CPE, удовлетворяют необходимым предварительным требованиям для зачисления на CH 101, Химия: молекулярная наука или CH 103, Общая химия I для студентов химических наук .
Учащиеся с достаточным уровнем подготовки по химии, на что указывает «проходной» балл на CPE, удовлетворяют необходимым предварительным требованиям для зачисления на CH 101, Химия: молекулярная наука или CH 103, Общая химия I для студентов химических наук .
Те учащиеся, которым показана исправительная работа, имеют следующие варианты выполнения предварительных условий для зачисления в CH 101 или CH 103: (1) сдать и сдать на C- или выше, CH 111, подготовительная химия или (2) выбрать удовлетворительно завершить серию онлайн-модулей и последующий оценочный экзамен.Подробнее см. ниже в Разделе IX.
Тест CPE состоит из 4 вопросов и 36 вопросов по химии и математике. CPE развертывается онлайн через Moodle, систему управления курсами. Для входа на сайт Moodle учащиеся должны иметь свой идентификатор Unity, выданный штатом Северная Каролина, и пароль. У студентов будет 60 минут после доступа к экзамену, чтобы ответить на вопросы. Разрешен только один вход в систему; каждый вопрос допускает одно представление. Студентам также понадобится калькулятор, способный выполнять экспоненциальные и логарифмические вычисления.В рамках экзамена предоставляется веб-ссылка на периодическую таблицу.
Студентам также понадобится калькулятор, способный выполнять экспоненциальные и логарифмические вычисления.В рамках экзамена предоставляется веб-ссылка на периодическую таблицу.
Это относится ко мне?
- CPE является обязательным для всех студентов, желающих поступить в CH 101 или CH 103 в течение учебного года. Нельзя зарегистрироваться в программе CH 101 без удовлетворительного прохождения CPE.
- Сдайте CPE: (i) если вы рассматриваете возможность обучения по основной программе или программе получения степени, требующей CH 101 или CH 103, даже если вы не уверены в этом, или (ii) если вы намереваетесь или думаете, что захотите изменить специальность или программу получения степени на ту, которая требуется CH 101 или CH 103.
- CPE НЕ применяется к учащимся, желающим зарегистрироваться в CH 111 или CH 100, и не требуется для студентов, которым не нужно регистрироваться в CH 101 . CPE является обязательным условием только для каналов CH 101 и CH 103.

- Для получения дополнительной информации по колледжу см.:
Учащиеся с ограниченными возможностями
Чтобы иметь право на размещение во время тестирования, учащийся должен (1) зарегистрироваться в офисе DRO в Университете штата Северная Каролина и (2) запросить размещение для CPE.См.: https://dro.dasa.ncsu.edu
.- Организовать отправку подтверждения регистрации в DRO доктору Уоррену по адресу [email protected];
- Зарегистрируйтесь на курсе CPE Moodle, но НЕ открывайте само CPE;
- Электронное письмо доктору Уоррену, чтобы подтвердить, что вы зарегистрировались на курс CPE Moodle;
- После того, как будет установлено временное окно для размещения, с вами свяжутся по электронной почте;
- Вы можете начать CPE в удобное для вас время.
CPE Логистика
КОНКРЕТНЫЕ ИНСТРУКЦИИ ПО ПОДГОТОВКЕ К CPE И ДОСТУПУ К нему СМОТРИТЕ В РАСПРЕДЕЛИТЕЛЬНОМ МЕНЮ СЛЕВА.
Контактная информация
Доктор Роберт Уоррен (rwwarren@ncsu.

 Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.
Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.


 (при условии того, что вы в состоянии решить остальное хотя бы в 70%). Если вы начали часть 2, то проходной балл вы должны набирать без какого-либо проблем в 100% случаев. Если этого не происходит, лучше пока оставаться на первой части. Когда вы будете готовы к части 2, рекомендуем обзавестись отдельной тетрадкой, где вы будете записывать только решения части 2. Залог успеха это нарешивание как можно большего объема заданий как и в части 1.
(при условии того, что вы в состоянии решить остальное хотя бы в 70%). Если вы начали часть 2, то проходной балл вы должны набирать без какого-либо проблем в 100% случаев. Если этого не происходит, лучше пока оставаться на первой части. Когда вы будете готовы к части 2, рекомендуем обзавестись отдельной тетрадкой, где вы будете записывать только решения части 2. Залог успеха это нарешивание как можно большего объема заданий как и в части 1. Именно второй блок обычно занимает больше времени, поэтому испытуемому необходимо рационально распределять время.
Именно второй блок обычно занимает больше времени, поэтому испытуемому необходимо рационально распределять время. Не пренебрегайте школьным образованием, внимательно выполняйте задания на уроках!
Не пренебрегайте школьным образованием, внимательно выполняйте задания на уроках!
 Из-за этих взаимосвязей отдельные вопросы могут проверять более чем одну область химии.
Из-за этих взаимосвязей отдельные вопросы могут проверять более чем одну область химии. Электронное строение, возникновение и восстановление, физические и химические свойства элементов и их соединений, координационная химия
Электронное строение, возникновение и восстановление, физические и химические свойства элементов и их соединений, координационная химия Химия и природа карбокатионов, карбанионов, свободных радикалов, карбенов, бензинов, енолов
Химия и природа карбокатионов, карбанионов, свободных радикалов, карбенов, бензинов, енолов