Вакцианция против гриппа — что это и для чего?
Дата добавления: 26 июля 2018 г.
Вакцинация против гриппа используется с целью профилактики распространения вирусов в сообществах людей. Особенно рекомендуется вакцинация от гриппа в закрытых учреждениях, таких как школы, детские сады, супермаркеты, больницы. Правильно проведенная вакцинация от гриппа препятствует распространению вируса, прерывает цепочку его трансформации. Как показывает практика, если больше 40 % членов коллектива получили прививку от гриппа, то число заболевших среди не привитых людей не превышает 10 %.
Вирус гриппа постоянно меняется, поэтому каждый год разрабатывается новая вакцина. После ее введения организм в течение двух недель вырабатывает защитные антитела, которые действуют целый год. Если человек и заболевает после вакцинации, то в этом случае грипп протекает в более легкой форме.
Существуют категории людей, которым вакцинацию нужно провести в первую очередь:
- Людям старше 60 лет;
- Больным хроническими соматическими (не психическими) заболеваниями;
- Часто болеющим ОРЗ;
- Детям дошкольного возраста и школьникам;
- Сотрудникам медицинских учреждений, работникам сферы обслуживания, транспорта, учебных заведений.

Состав вакцины от гриппа
Инактивированная (убитая) вакцина от гриппа содержит очищенные антигены (чуждые для организма вещества, вызывающие образование в организме антител) вирусов гриппа типа А и В.
Состав вакцины от гриппа для каждого сезона заболеваемости определяется Всемирной организацией здравоохранения (ВОЗ), Европейским сообществом, Руководством здравоохранения США и Австралии (обычно существуют различия в ежегодном составе для северного и южного полушарий).
Как достигается безопасность вакцин?
Вакцины безопасны, поскольку проходят многоступенчатую очистку, в них отсутствуют консерванты и ртутьсодержащие вещества. Поэтому вакцинацию можно проводить, детям начиная с шестимесячного возраста.
Профилактические прививки против гриппа
Оптимальным считается введение вакцины внутримышечно или подкожно (обычно этот способ используется для пациентов, у которых проблемы со свертываемостью крови) до начала сезона гриппа. Профилактические прививки против гриппа проводятся ежегодно.
К сведению
Поскольку структура вируса гриппа постоянно меняется, вакцинацию нужно проводить ежегодно.
Детям старше 6 лет и взрослым вводится одна доза, в которой содержится 0,5 мл вакцины.
Младенцам и детям до 6 лет вводятся две дозы вакцины по 0,25 мл с интервалом в 4 недели (если ребенок был ранее вакцинирован, то ему достаточно ввести одну дозу, содержащую 0,25 мл вакцины).
Как организм реагирует на прививку?
Побочные реакции крайне редки. У небольшой группы людей может покраснеть и распухнуть место прививки, немного подняться температура, возникнуть мышечная боль. Неблагоприятные симптомы исчезают сами (обычно за 1—2 дня).
Иногда у людей, склонных к аллергии, возникают аллергические реакции на отдельные компоненты вакцины.
Противопоказания для прививки от гриппа
 Чтобы избежать анафилактической (аллергической) реакции, после введения вакцины нужно в течение 30 минут находиться под медицинским наблюдением. Существуют специфические противопоказания для прививки от гриппа.
Чтобы избежать анафилактической (аллергической) реакции, после введения вакцины нужно в течение 30 минут находиться под медицинским наблюдением. Существуют специфические противопоказания для прививки от гриппа.Нельзя делать прививку от гриппа, если:
- Человек страдает аллергией на белок куриного яйца — в таком случае сама прививка может вызвать аллергическую реакцию;
- Раньше были тяжелые реакции на подобные прививки;
- В день введения вакцины выявились признаки простудного или инфекционного заболевания;
- Обострились хронические недуги — в таком случае нужно ждать, пока исчезнут все симптомы заболевания.
Конечно, есть еще и другие причины, при которых приходится отказываться от вакцинации, но это уже в индивидуальном порядке решает врач.
Реакция на прививку
Местные реакции на вакцинацию возникают обычно в области введения прививки: краснота, небольшой отек, тяжесть в месте укола. Появляются неблагоприятные симптомы на 1 —2 сутки после вакцинации и через 2—3 дня бесследно проходят.
Общие реакции — небольшое (до 38 °С) повышение температуры, снижение аппетита, недомогание. Не следует пугаться: это означает, что прививка «работает».
Но если температура повышается до 38,5 °С и выше, возникает ощущение слабости и разбитости, выраженный отек, боль, нагноение в месте инъекции, то это отклонения от нормы. В подобном случае обязательно нужно обратиться к врачу.
Вакцины для профилактики гриппа
В настоящее время используются различные вакцины для профилактики гриппа. У каждой вакцины есть свои преимущества. Самая доступная по цене — отечественная вакцина «Гриппол». Она обеспечивает эффективную защиту от вируса. Именно ее делают бесплатно детям в школах, детских садах и т. д.
Импортные вакцины подвергаются более сложной многоступенчатой очистке. Поэтому побочных реакций (повышения температуры, недомогания, головной боли, красноты, сыпи) возникает меньше.
Названия вакцины против гриппа
Названия вакцины против гриппа может быть вам не знакомо. Производители ежегодно выпускают новые серии профилактических препаратов. Лучше всего перед вакцинацией проконсультироваться с врачом инфекционистом или терапевтом.
Производители ежегодно выпускают новые серии профилактических препаратов. Лучше всего перед вакцинацией проконсультироваться с врачом инфекционистом или терапевтом.
Инактивированные (неживые) вакцины (инфлювак, агриппал) содержат поверхностные антигены (частицы, способствующие выработке антител) вируса гриппа. Зашита при этом будет несколько ниже, но безопасность прививки больше. Такими вакцинами можно прививать даже беременных и кормящих грудью женщин. Детям инактивированные вакцины можно вводить, начиная с 6 месяцев.
Сплит — вакцины (ваксигрип, бегривак, флюарикс) содержат частицы разрушенного вируса, и является достаточно эффективными и безопасными. За счет высокой очистки в сплит-вакцинах отсутствуют вирусные липиды и белки куриного эмбриона.
Инфлювак® (вакцина гриппозная субъединичная инактивированная) (Influvac®)
Фармакологическое действие — формирующее развитие специфического иммунитета.
Фармакодинамика

Показания препарата Инфлювак
® (вакцина гриппозная субъединичная инактивированная)Вакцинация рекомендуется всем лицам и, прежде всего, следующим категориям населения, подвергающимся повышенному риску в случае сочетания гриппа с уже имеющимися заболеваниями/состояниями:
лицам старше 65 лет вне зависимости от состояния их здоровья;
больным с заболеваниями органов дыхания;
больным с сердечно-сосудистыми заболеваниями любой этиологии;
больным хронической почечной недостаточностью;
больным сахарным диабетом;
больным с иммунодефицитными заболеваниями (ВИЧ-инфекция, злокачественные заболевания крови и др. ) и больным, получающим иммунодепрессанты, цитостатики, лучевую терапию или высокие дозы кортикостероидов;
) и больным, получающим иммунодепрессанты, цитостатики, лучевую терапию или высокие дозы кортикостероидов;
детям и подросткам (от 6 мес до 18 лет), получающим в течение длительного времени препараты, содержащие ацетилсалициловую кислоту, и, следовательно, подверженным повышенному риску развития синдрома Рея вследствие гриппозной инфекции;
беременным женщинам (II–III триместр). Беременным женщинам, принадлежащим к категориям, подвергающимся повышенному риску, следует вакцинироваться независимо от стадии беременности.
Противопоказания
гиперчувствительность к куриному белку или к любому другому компоненту вакцины;
сильные температурные или аллергические реакции после предыдущей вакцинации субъединичными гриппозными вакцинами.
Вакцинация откладывается до окончания острых проявлений заболевания и обострения хронических заболеваний. При нетяжелых ОРВИ, острых кишечных и других заболеваниях вакцинацию проводят сразу же после нормализации температуры.
Применение при беременности и кормлении грудью
Опыт применения показывает, что Инфлювак® не оказывает тератогенного или токсического действия на плод. Вакцину Инфлювак® можно использовать в период лактации.
Побочные действия
Со стороны кровеносной и лимфатической системы: редко — тромбоцитопения.
Со стороны иммунной системы: редко — возможны аллергические реакции; очень редко — анафилактический шок.
Со стороны нервной системы: часто — головная боль; редко — парестезии, судороги, энцефаломиелит, неврит, синдром Гийена-Барре.
Однако убедительных данных о связи этих реакций с вакцинацией не установлено.
Со стороны сосудистой системы: очень редко — васкулит с транзиторным нарушением функции почек.
Общие расстройства: часто — утомляемость и невралгия, не требующие лечения и проходящие через 1–2 дня.
Местные реакции: покраснение, припухлость, болезненность, уплотнение, экхимозы.
Системные реакции: повышение температуры тела, недомогание, дрожь, потливость, болезненность в мышцах и суставах.
В помещении, где проводится вакцинация, необходимо иметь ЛС для лечения анафилактического шока (адреналин, глюкокортикоиды и др.).
Взаимодействие
Инфлювак® можно применять одновременно с другими вакцинами (вакцины следует вводить в разные участки тела разными шприцами). Возможно усиление побочных эффектов.
Возможно усиление побочных эффектов.
Если пациент получает иммуносупрессивную терапию, иммунный ответ может быть снижен.
После вакцинации возможно получение ложноположительных результатов серологических тестов (при проведении иммунно-ферментного анализа (ИФА), которые обусловлены выработкой IgM после вакцинации.
Несовместимость: случаи несовместимости неизвестны.
Способ применения и дозы
В/м или п/к (глубоко). Категорически запрещается вводить препарат в/в. Иммунизацию проводят ежегодно в осенний период. Взрослым и подросткам (с 14 лет) — 0,5 мл однократно, детям: от 6 мес до 3 лет — 0,25 мл, от 3 до 14 лет — 0,5 мл однократно; детям, ранее не болевшим гриппом и не вакцинированным, а также больным с иммунодефицитом — двукратно с интервалом в 4 нед.
Категорически запрещается вводить препарат в/в. Иммунизацию проводят ежегодно в осенний период. Взрослым и подросткам (с 14 лет) — 0,5 мл однократно, детям: от 6 мес до 3 лет — 0,25 мл, от 3 до 14 лет — 0,5 мл однократно; детям, ранее не болевшим гриппом и не вакцинированным, а также больным с иммунодефицитом — двукратно с интервалом в 4 нед.
Меры предосторожности
Препарат может содержать неопределяемое остаточное количество гентамицина, поэтому при вакцинации лиц с повышенной чувствительностью к аминогликозидам следует соблюдать осторожность.
Особые указания
Вакцина сохраняет свои свойства в течение 12 мес. Сроком истечения годности считается 30 июня года, следующего за годом выпуска. Не следует использовать после истечения указанного на упаковке срока годности.
Указания по обращению с одноразовыми шприцами
Перед введением вакцина должна нагреться до комнатной температуры. Непосредственно перед инъекцией шприц необходимо встряхнуть, снять защитный колпачок с иглы и удалить воздух из шприца, удерживая его в вертикальном положении иглой вверх и медленно нажимая на поршень. При введении дозы 0,25 мл движение поршня шприца останавливают в момент, когда его внутренняя поверхность достигает нижнего края фиксатора иглы.
Производитель
Солвей Фармасьютикалз Б. В., Нидерланды.
В., Нидерланды.
В защищенном от света месте, при температуре 2–8 °C (не замораживать)
Хранить в недоступном для детей месте.
Не применять по истечении срока годности, указанного на упаковке.
последние отзывы, производитель, срок годности
Вакцина необходима для того, чтобы защитить организм от заболевания и его последствий. Так как иммунитет начинает вырабатываться на второй день после прививки, то делать ее рекомендуется за несколько дней до того, как начнется эпидемия.
Вакцинирование для профилактики гриппа
Предупредить грипп позволяет препарат «Инфлювак». Инструкция по применению утверждает, что вакцина развивает форму иммунитета, противостоящую вирусам группы А и В. Иммунитет появляется через 2 недели после полной иммунизации. Срок ее действия составляет 1 год.
Иммунитет появляется через 2 недели после полной иммунизации. Срок ее действия составляет 1 год.
Для прививки выбирают неживые вакцины, например, «Инфлювак» — препарат, который содержит поверхностные частицы вируса гриппа. Они и формируют иммунитет у пациента. Можно отдать предпочтение и сплит-вакцине, которая содержит клетки вируса в разрушенном виде.
Каждая из этих вакцин совершенно безопасная и по действию обеспечивают одинаковый барьер для иммунитета. Живого вируса ни в одной инъекции нет. От гриппа гарантировано защитит вакцина «Инфлювак». Инструкция по применению, отзывы — это дополнительное свидетельство того, что инъекция эффективная и безопасная.
Как правило, отечественная и импортная вакцина отличаются двумя признаками:
- Очистка препарата, производимая на двух стадиях.
- Контроль качества.
Благодаря этим преимуществам, вакцина «Инфлювак» не вызывает побочные эффекты, поэтому ее можно делать даже самым маленьким детям в возрасте 6 месяцев, а также людям, имеющим хронические заболевания, беременным или кормящим грудью женщинам.
Противопоказания к вакцине
Инструкция по применению «Инфлювак» содержит определенные противопоказания для вакцинации, среди которых:
- Болезнь на стадии обострения или хроническая форма недуга в день вакцинации.
- Высокая чувствительность или аллергия на куриный белок.
- Аллергическая реакция на некоторые составляющие вакцины.
- Неожиданная и тяжелая реакция на предыдущую прививку этим лекарством.
Кроме того, вакцинация пациента откладывается, если он болеет нетяжелой формой простуды или есть острая кишечная инфекция, в результате которой и проявляется высокая температура.
Побочная реакция на вакцину «Инфлювак»
Возможны также побочные эффекты после вакцинирования препаратом «Инфлювак». Инструкция по применению не отрицает развитие осложнений в некоторых случаях, но это бывает у небольшого количества привитых людей. Медицинские данные показывают, что среди взрослых общая реакция проявилась только у 1% пациентов, которым была сделана вакцинация, а у 4% населения была отмечена местная. Что касается обострений или осложнений после инъекций, таковых не было зарегистрировано.
Что касается обострений или осложнений после инъекций, таковых не было зарегистрировано.
Реакция на вакцину может быть местной или общей, каждая имеет свои симптомы. Для общей реакции характерны такие признаки, как:
- Повышенная температура тела некоторое время, не выше, чем 37,5.
- Состояние озноба.
- Непродолжительная слабость тела, частая утомляемость и признаки невралгии.
- Такое состояние наблюдается максимум 1 день.
Симптомы местной реакции на вакцину «Инфлювак» инструкция отмечает следующие:
- Легкое покраснения места, куда делали инъекцию.
- Уплотнение небольшого размера.
- В некоторых случаях появляется боль.
- Такая реакция длится максимум 2 дня и не создает сильного дискомфорта.
В любом случае если появилась побочная реакция на инъекцию от гриппа, это говорит о том, что иммунная система работает в полную силу. В некоторых случаях может наступить анафилактический шок, поэтому в кабинете, где делают инъекцию, должны быть медикаменты для его снятия, например, адреналин.
«Инфлювак» не оказывает никакого воздействия на способность управлять любым транспортным средством, это касается и других машин или механизмов.
Побочная реакция со стороны организма
В некоторых случаях, вакцина от гриппа «Инфлювак» (инструкция предупреждает) вызывает осложнения и со стороны отдельных органов тела.
В результате прививки может пострадать кровеносная и лимфатическая система, что повлечет за собой понижение количества тромбоцитов, следовательно, высокий риск кровотечения и проблем с ним.
Со стороны иммунитета возникают аллергические реакции, а в некоторых случаях даже анафилактический шок.
Поражение нервной системы вызывает мигрень, очень редко паралич и судороги, а также энцефаломиелит или неврит. Но исследования не показывают, что между вакциной и такой реакцией есть связь.
Нарушения сосудистой системы влекут за собой васкулит, который сопровождается транзиторными изменениями, что касается функционирования почек.
Назначение вакцины «Инфлювак».
 Инструкция по применению
Инструкция по применениюПрививка помогает не только защитить организм, но и провести профилактику, например у маленьких детей. Кроме того, в первую очередь вакцинируют людей, которые находятся в группе повышенного риска. Это население в возрасте старше 65 лет, имеющие заболевания дыхательных органов или сердца, страдающие хронической почечной недостаточностью, диабетики. Также в эту группу входят люди, обладающие слабым иммунитетом, кто принимает средства, угнетающие его работу, или проходящие лечебную терапию против ракового заболевания, кто получает высокую дозу кортикостероидов.
Вакцинирование проходят дети в школьном и подростковом возрасте до 18 лет, особенно те, кто долго принимал медикаменты, в составе которых была ацетилсалициловая кислота. Они подвергаются риску заболеть синдромом Рея, который развивается, как появляется побочная реакция после инфекционного гриппа.
Как правило, вакцину делают беременным женщинам во 2-м или 3-м триместре, но если существует высокий риск заражения, тогда прививание осуществляется на любом сроке лекарством «Инфлювак».![]() Инструкция по применению предусматривает такие меры вакцинирования.
Инструкция по применению предусматривает такие меры вакцинирования.
Метод применения и допустимые дозы
Согласно установленным требованиям, вакцинация проводится каждый год в осенний период. Инъекция вводится внутримышечно или глубоко под кожу. Введение внутривенно любой инъекции не допускается. Под такое строгое правило попадает и вакцина «Инфлювак». Инструкция подробно описывает, как правильно использовать препарат.
- Детям от 6-ти месяцев и до 3-х лет вводят 0,25 мл препарата.
- От 3-х до 14 лет вводят 0,5 мл вакцины, однократно.
- Взрослым и подросткам в возрасте от 14 лет вакцина вводится один раз, объемом 0,5 мл.
- Детям, которые раньше не болели гриппом или, кто не проходил вакцинирование, проводят процедуру два раза с интервалом 4 недели.
Безопасность вакцины «Инфлювак»
Независимые исследования, которые проводятся экспертами ВОЗ, подтверждают, что современные вакцины обладают высокой эффективностью, потому что содержат именно поверхностные элементы заболевания. Они обладают низкой реактогенностью, простыми словами, в минимальном случае вызывают побочную реакцию на укол.
Они обладают низкой реактогенностью, простыми словами, в минимальном случае вызывают побочную реакцию на укол.
Препарат не содержит консервантов, прошел многочисленные исследования в различных странах, где принимали участия более 100 тысяч человек. И за все время исследований не было отмечено ни единого случая, когда появлялись выраженные или неизвестные побочные эффекты.
После введения препарата человеческий организм медленно производит защиту против гриппа, необходимый уровень уже достигается в конце второй недели, в большинстве случаев, прививание людей сопровождалось нормальной температурой тела.
Эффективность вакцинации препаратом «Инфлювак»
Преимущество препарата достигается за счет его эффективности, этому способствуют:
- Высокие технологии используются для создания вакцины «Инфлювак». Инструкция по применению, производитель и мировые стандарты подтверждают этот факт.
- Препарат «Инфлювак» удовлетворяет все требования ВОЗ.
- На протяжении 10-ти лет прививка успешно применяется среди населения.

- Многочисленные исследования прошла вакцина «Инфлювак». Инструкция по применению содержит всю необходимую информацию.
Эффективность прививки дополняется еще одним положительным качеством, которое называется «Умный шприц». Дело в том, что многие отказываются вакцинироваться именно из-за страха перед уколом, производитель учел этот недостаток и выпустил современную инъекцию, которая очень удобная в использовании и называется «Дюфарджект».
Система позволяет ввести точную дозу, она герметичная и не требует специальной упаковки, что экономит время в процессе массовой вакцинации. А игла настолько тонкая, что укол не почувствуется совсем, так как она покрыта силиконом и заточена алмазами.
«Инфлювак», инструкция по применению, срок годности
Благодаря своим качествам, прививка может сохранять свои свойства на протяжении года. Чтобы различить вакцины по сроку годности, производитель указывает дату изготовления в инструкции, после истечения которой препарат запрещено использовать.![]() Как правило, именно 30 июня истекает срок использования инъекции предыдущего года выпуска.
Как правило, именно 30 июня истекает срок использования инъекции предыдущего года выпуска.
Чтобы соблюдались сроки годности, необходимо и правильно хранить, а также транспортировать препарат. Необходима защита от прямого попадания солнечных лучей, соблюдение температуры в пределах от 2 до 8 градусов. Максимальная температура транспортировки «Инфлювака» достигает 25 градусов в течение 24-х часов. Следует беречь от детей и не допускать замораживания.
Вакцины от коронавируса (COVID-19)
последнее обновление: 17.01.2022 14:36
Что при этом происходит с курсом валют?
Узнайте в приложении от Минфин
Здесь представлена информация о всех вакцинах против COVID-19, которые используются в различных странах мира. Данные доступны для стран, сообщающих статистику по вакцинации.
Ниже приводится перечень известных вакцин от COVID-19 со списком стран, в которых разрешена та или иная вакцина.
Напомним, данные даются по тем странам, которые официально публикуют соответствующую информацию.
- Abdala
Венесуэла, Вьетнам, Куба, Никарагуа - CanSino
Аргентина, Китай, Малайзия, Мексика, Пакистан, Чили, Эквадор - Covaxin
Ботсвана, Индия, Иран, Коморские острова, Маврикий, Непал, Пакистан, Парагвай, Центральноафриканская Республика - COVIran Barekat
Иран - EpiVacCorona
Россия, Туркмения - Johnson&Johnson
Австрия, Афганистан, Багамские Острова, Белиз, Бельгия, Бенин, Болгария, Боливия, Ботсвана, Бразилия, Британские Виргинские Острова, Бруней, Буркина-Фасо, Венгрия, Гаити, Гамбия, Германия, Гондурас, Гренада, Греция, Дания, Джибути, Египет, Замбия, Индонезия, Ирландия, Исландия, Испания, Италия, Йемен, Камбоджа, Камерун, Кипр, Колумбия, Кот-д’Ивуар, Кувейт, Лаос, Латвия, Лесото, Ливия, Литва, Лихтенштейн, Люксембург, Мадагаскар, Малави, Мальта, Марокко, Мексика, Мозамбик, Молдова, Намибия, Непал, Нидерланды, Никарагуа, Норвегия, Палестина, Польша, Португалия, Руанда, Румыния, США, Сенегал, Сирия, Словакия, Словения, Сомали, Судан, Танзания, Тринидад и Тобаго, Тунис, Уганда, Украина, Филиппины, Франция, Французская Полинезия, Хорватия, Чехия, Швейцария, Эсватини, Эстония, ЮАР, Южная Корея, Южный Судан, Ямайка - Medigen
Тайвань - Moderna
Австралия, Австрия, Андорра, Аргентина, Армения, Бангладеш, Бельгия, Болгария, Ботсвана, Бруней, Бутан, Великобритания, Венгрия, Вьетнам, Гаити, Гватемала, Германия, Гернси, Гондурас, Гренландия, Греция, Дания, Джерси, Израиль, Индонезия, Ирландия, Исландия, Испания, Италия, Кабо-Верде, Канада, Карибские Нидерланды, Катар, Кипр, Колумбия, Кувейт, Кюрасао, Латвия, Ливия, Литва, Лихтенштейн, Люксембург, Мальта, Мексика, Непал, Нидерланды, Норвегия, Остров Мэн, Пакистан, Палестина, Парагвай, Польша, Португалия, Республика Конго, Руанда, Румыния, США, Сингапур, Синт-Мартен, Словакия, Словения, Таджикистан, Тайвань, Тунис, Уганда, Узбекистан, Украина, Уоллис и Футуна, Фарерские острова, Филиппины, Финляндия, Франция, Хорватия, Чехия, Швейцария, Швеция, Шри-Ланка, Эстония, Южная Корея, Ямайка, Япония - Novavax
Индонезия - Oxford/AstraZeneca
Австралия, Австрия, Азербайджан, Албания, Алжир, Ангилья, Ангола, Андорра, Антигуа и Барбуда, Аргентина, Армения, Афганистан, Багамские Острова, Бангладеш, Барбадос, Бахрейн, Белиз, Бельгия, Бенин, Бермудские Острова, Болгария, Боливия, Босния и Герцеговина, Ботсвана, Бразилия, Британские Виргинские Острова, Бруней, Буркина-Фасо, Бутан, Вануату, Великобритания, Венгрия, Восточный Тимор, Вьетнам, Гайана, Гамбия, Гана, Гватемала, Гвинея-Бисау, Германия, Гернси, Гондурас, Гренада, Греция, Грузия, Дания, Демократическая Республика Конго, Джерси, Джибути, Доминика, Доминиканская Республика, Египет, Замбия, Зимбабве, Индия, Индонезия, Иордания, Ирак, Иран, Ирландия, Исландия, Испания, Италия, Йемен, Кабо-Верде, Каймановы Острова, Камбоджа, Камерун, Канада, Кения, Кипр, Кирибати, Колумбия, Коморские острова, Косово, Коста-Рика, Кот-д’Ивуар, Кувейт, Лаос, Латвия, Лесото, Либерия, Ливан, Ливия, Литва, Люксембург, Маврикий, Мавритания, Мадагаскар, Македония, Малави, Малайзия, Мали, Мальдивы, Мальта, Марокко, Мексика, Мозамбик, Молдова, Монголия, Монтсеррат, Мьянма, Намибия, Науру, Непал, Нигер, Нигерия, Нидерланды, Никарагуа, Ниуэ, Новая Зеландия, Норвегия, Объединенные Арабские Эмираты, Оман, Остров Мэн, Остров Святой Елены, Пакистан, Палестина, Панама, Папуа-Новая Гвинея, Парагвай, Перу, Польша, Португалия, Республика Конго, Руанда, Румыния, Сальвадор, Самоа, Сан-Томе и Принсипи, Саудовская Аравия, Северный Кипр, Сейшельские Острова, Сенегал, Сент-Винсент и Гренадины, Сент-Китс и Невис, Сент-Люсия, Сербия, Синт-Мартен, Сирия, Словакия, Словения, Соломоновы Острова, Сомали, Судан, Суринам, Сьерра-Леоне, Таджикистан, Таиланд, Тайвань, Того, Тонга, Тринидад и Тобаго, Тувалу, Тунис, Туркмения, Уганда, Узбекистан, Украина, Уругвай, Фиджи, Филиппины, Финляндия, Фолклендские острова, Франция, Хорватия, Центральноафриканская Республика, Черногория, Чехия, Чили, Швеция, Шри-Ланка, Эквадор, Эсватини, Эстония, Эфиопия, Южная Корея, Южный Судан, Ямайка, Япония - Pfizer/BioNTech
Австралия, Австрия, Азербайджан, Албания, Ангилья, Андорра, Антигуа и Барбуда, Аргентина, Аруба, Афганистан, Багамские Острова, Бангладеш, Барбадос, Бахрейн, Белиз, Бельгия, Бенин, Бермудские Острова, Болгария, Боливия, Босния и Герцеговина, Ботсвана, Бразилия, Бруней, Бутан, Великобритания, Венгрия, Восточный Тимор, Вьетнам, Габон, Германия, Гернси, Гибралтар, Гондурас, Гонконг, Гренада, Греция, Грузия, Дания, Джерси, Джибути, Доминика, Доминиканская Республика, Египет, Израиль, Индонезия, Иордания, Ирак, Ирландия, Исландия, Испания, Италия, Кабо-Верде, Каймановы Острова, Камерун, Канада, Карибские Нидерланды, Катар, Кипр, Колумбия, Косово, Коста-Рика, Кот-д’Ивуар, Кувейт, Кюрасао, Лаос, Латвия, Ливан, Ливия, Литва, Лихтенштейн, Люксембург, Макао, Македония, Малайзия, Мальдивы, Мальта, Марокко, Мексика, Молдова, Монако, Монголия, Намибия, Непал, Нидерланды, Никарагуа, Новая Зеландия, Новая Каледония, Норвегия, Объединенные Арабские Эмираты, Оман, Остров Мэн, Острова Кука, Пакистан, Палестина, Панама, Парагвай, Перу, Польша, Португалия, Руанда, Румыния, США, Сальвадор, Сан-Марино, Саудовская Аравия, Северный Кипр, Сент-Китс и Невис, Сент-Люсия, Сербия, Сингапур, Синт-Мартен, Словакия, Словения, Судан, Суринам, Таджикистан, Таиланд, Тайвань, Танзания, Теркс и Кайкос, Тринидад и Тобаго, Тунис, Турция, Уганда, Украина, Уругвай, Фарерские острова, Филиппины, Финляндия, Франция, Французская Полинезия, Хорватия, Черногория, Чехия, Чили, Швейцария, Швеция, Шри-Ланка, Эквадор, Эсватини, Эстония, ЮАР, Южная Корея, Ямайка, Япония - QazVac
Казахстан - Sinopharm/Beijing
Алжир, Аргентина, Армения, Афганистан, Бангладеш, Барбадос, Бахрейн, Беларусь, Белиз, Боливия, Бруней, Буркина-Фасо, Бурунди, Бутан, Венгрия, Венесуэла, Вьетнам, Габон, Гамбия, Гвинея-Бисау, Грузия, Джибути, Доминика, Доминиканская Республика, Египет, Замбия, Зимбабве, Индонезия, Иордания, Ирак, Иран, Кабо-Верде, Казахстан, Камбоджа, Камерун, Киргизия, Китай, Коморские острова, Кот-д’Ивуар, Кувейт, Лаос, Латвия, Лесото, Ливан, Ливия, Маврикий, Мавритания, Мадагаскар, Макао, Македония, Малайзия, Мальдивы, Марокко, Мозамбик, Молдова, Монголия, Мьянма, Намибия, Непал, Нигер, Объединенные Арабские Эмираты, Пакистан, Палестина, Парагвай, Перу, Республика Конго, Руанда, Сальвадор, Сейшельские Острова, Сенегал, Сербия, Сингапур, Сирия, Сомали, Судан, Суринам, Сьерра-Леоне, Таиланд, Танзания, Тринидад и Тобаго, Тунис, Туркмения, Филиппины, Чад, Черногория, Шри-Ланка, Экваториальная Гвинея - Sinopharm/Wuhan
Китай, Объединенные Арабские Эмираты - Sinovac
Азербайджан, Албания, Алжир, Армения, Бенин, Босния и Герцеговина, Ботсвана, Бразилия, Венесуэла, Восточный Тимор, Гонконг, Грузия, Джибути, Доминиканская Республика, Египет, Зимбабве, Индонезия, Йемен, Камбоджа, Китай, Колумбия, Лаос, Ливия, Македония, Малайзия, Мексика, Оман, Пакистан, Палестина, Парагвай, Руанда, Сальвадор, Северный Кипр, Сингапур, Сирия, Сомали, Судан, Таджикистан, Таиланд, Тунис, Турция, Уганда, Украина, Уругвай, Филиппины, Чили, Эквадор - Soberana02
Иран, Куба, Никарагуа - Sputnik Light
Лаос, Никарагуа, Палестина, Сирия - Sputnik V
Азербайджан, Албания, Алжир, Антигуа и Барбуда, Аргентина, Армения, Бахрейн, Беларусь, Боливия, Босния и Герцеговина, Венгрия, Венесуэла, Вьетнам, Габон, Гайана, Гана, Гвинея, Гондурас, Джибути, Египет, Зимбабве, Индия, Иордания, Ирак, Иран, Казахстан, Кения, Киргизия, Кот-д’Ивуар, Лаос, Ливан, Ливия, Македония, Марокко, Мексика, Молдова, Монголия, Непал, Никарагуа, Объединенные Арабские Эмираты, Оман, Пакистан, Палестина, Парагвай, Республика Конго, Россия, Руанда, Сан-Марино, Сейшельские Острова, Сербия, Сирия, Словакия, Таджикистан, Тунис, Туркмения, Узбекистан, Филиппины, Черногория, Шри-Ланка - ZF2001
Китай, Узбекистан
Для некоторых стран доступны не только сведения о количестве вацкинаций, но и данные о количестве вакцинаций различными вакцинами. Это такие страны, как Австрия, Бельгия, Болгария, Венгрия, Германия, Гонконг, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Лихтенштейн, Люксембург, Мальта, Нидерланды, Норвегия, Перу, Польша, Португалия, Румыния, США, Словакия, Словения, Украина, Уругвай, Финляндия, Франция, Хорватия, Чехия, Чили, Швейцария, Швеция, Эквадор, Эстония, Южная Корея, Япония.
Сводные данные по ним представлены в приведенной ниже таблице.
Это такие страны, как Австрия, Бельгия, Болгария, Венгрия, Германия, Гонконг, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Лихтенштейн, Люксембург, Мальта, Нидерланды, Норвегия, Перу, Польша, Португалия, Румыния, США, Словакия, Словения, Украина, Уругвай, Финляндия, Франция, Хорватия, Чехия, Чили, Швейцария, Швеция, Эквадор, Эстония, Южная Корея, Япония.
Сводные данные по ним представлены в приведенной ниже таблице.
| Вакцина | Всего вакцинаций |
|---|---|
| CanSino | 1 050 602 |
| Чили, Эквадор | |
| Johnson&Johnson | 37 846 437 |
| Австрия, Бельгия, Болгария, Венгрия, Германия, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Лихтенштейн, Люксембург, Мальта, Нидерланды, Норвегия, Польша, Португалия, Румыния, США, Словакия, Словения, Украина, Франция, Хорватия, Чехия, Швейцария, Эстония, Южная Корея | |
| Moderna | 356 270 247 |
| Австрия, Бельгия, Болгария, Венгрия, Германия, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Лихтенштейн, Люксембург, Мальта, Нидерланды, Норвегия, Польша, Португалия, Румыния, США, Словакия, Словения, Украина, Финляндия, Франция, Хорватия, Чехия, Швейцария, Швеция, Эстония, Южная Корея, Япония | |
| Oxford/AstraZeneca | 102 160 286 |
| Австрия, Бельгия, Болгария, Венгрия, Германия, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Люксембург, Мальта, Нидерланды, Норвегия, Перу, Польша, Португалия, Румыния, Словакия, Словения, Украина, Уругвай, Финляндия, Франция, Хорватия, Чехия, Чили, Швеция, Эквадор, Эстония, Южная Корея | |
| Pfizer/BioNTech | 1 077 193 004 |
| Австрия, Бельгия, Болгария, Венгрия, Германия, Гонконг, Дания, Ирландия, Исландия, Испания, Италия, Кипр, Латвия, Литва, Лихтенштейн, Люксембург, Мальта, Нидерланды, Норвегия, Перу, Польша, Португалия, Румыния, США, Словакия, Словения, Украина, Уругвай, Финляндия, Франция, Хорватия, Чехия, Чили, Швейцария, Швеция, Эквадор, Эстония, Южная Корея, Япония | |
| Sinopharm/Beijing | 21 257 414 |
| Венгрия, Латвия, Перу | |
| Sinovac | 56 890 505 |
| Гонконг, Украина, Уругвай, Чили, Эквадор | |
| Sputnik V | 1 845 067 |
| Венгрия, Словакия | |
Те же данные на диаграмме в процентах:
2,3%21,5%6,2%65,1%1,3%3,4%0,2%Johnson&JohnsonModernaOxford/AstraZenecaPfizer/BioNTechSinopharm/BeijingSinovacпрочиеВ рамках COVAX заказали почти 2 млрд доз вакцин от коронавируса
«Мы рады объявить сегодня, что COVAX зарезервировал доступ к почти 2 млрд доз нескольких обнадеживающих вакцин-кандидатов», — сказал Тедрос Гебрейесус. По его словам, «все 190 стран и экономических систем, участвующих в инициативе COVAX, смогут иметь доступ к банку вакцин уже в первой половине 2021 года».
По его словам, «все 190 стран и экономических систем, участвующих в инициативе COVAX, смогут иметь доступ к банку вакцин уже в первой половине 2021 года».
COVAX — это уникальная инициатива по производству и централизованной закупке вакцин от COVID-19. Она обеспечивает сотрудничество правительств и производителей в целях обеспечения того, чтобы вакцины были доступны как богатым странам, так и странам с низким уровнем дохода.
В ВОЗ отметили, что, по меньшей мере, 1,3 млрд доз будут предоставлены 92 странам с низким и средним уровнем дохода при финансовой поддержки доноров. Первые партии будут отправлены уже в первом квартале следующего года.
Два миллиарда доз вакцин были зарезервированы путем подписания соглашений о предварительных закупках с фармацевтическими компаниями. Так, 170 миллионов доз должно поступить от компании AstraZeneca, 500 миллионов — от производителя Johnson & Johnson, который в настоящее время разрабатывает вакцину, которая должна быть эффективна при однократном введении.
Эти договоренности стали дополнением к уже ранее подписанным соглашениям, заключенным COVAX с Индийским институтом сыворотки (SII) на поставку 200 миллионов доз, с возможностью увеличения до 900 миллионов доз вакцин-кандидатов от AstraZeneca/Oxford либо от Novavax. Было также подписано соглашение о намерениях по поставке вакцины — кандидата Sanofi/GSK.
Зарезервировав поставку двух миллиардов доз одобренных вакцин посредством прямых соглашений с производителями, в COVAX утвердили принципы их распределения. Предусмотрено также, что страны с более высокими доходами могут дополнительно закупать вакцину посредством двусторонних сделок, доступных через механизм COVAX, однако такие закупки должны осуществляться на справедливой основе. При этом в ВОЗ отметили, что все соглашения о закупках носят предварительный характер. В них предусмотрено, что поставляемая вакцина должна быть безопасной и эффективной.
Сегодня на брифинге в ВОЗ было объявлено, что поставки вакцин в рамках механизма COVAX запланированы уже на первый квартал 2021 года. Первая партия в объеме, достаточном для защиты медицинских и социальных работников, будет доставлена в первой половине следующего года в страны, которые участвуют в механизме COVAX и уже подали соответствующие заявки. В целом до конца 2021 года в рамках COVAX планируется охватить вакцинацией «до 20 процентов населения» стран, участвующих в международном механизме COVAX.
Первая партия в объеме, достаточном для защиты медицинских и социальных работников, будет доставлена в первой половине следующего года в страны, которые участвуют в механизме COVAX и уже подали соответствующие заявки. В целом до конца 2021 года в рамках COVAX планируется охватить вакцинацией «до 20 процентов населения» стран, участвующих в международном механизме COVAX.
Инфлювак Суспензия для инъекций — NPS MedicineWise
ЧТО СОДЕРЖИТСЯ В ЭТОЙ ЛИСТКЕ
В этой брошюре приведены ответы на некоторые распространенные вопросы о вакцине Инфлювак. Он не содержит всей доступной информации. Это не заменит разговора с вашим врачом или фармацевтом. Пожалуйста, внимательно прочтите его и сохраните для дальнейшего использования.
Все лекарства и вакцины имеют свои риски и преимущества. Ваш врач взвесил возможные риски, связанные с тем, что у вас есть Инфлювак, и ожидаемые преимущества.
Поговорите со своим врачом, медсестрой или фармацевтом, если у вас есть какие-либо опасения по поводу приема препарата Инфлювак.
Ваш врач и фармацевт могут получить дополнительную информацию.
ДЛЯ ЧЕГО ИСПОЛЬЗУЕТСЯ ИНФЛЮВАК
Инфлювак используется для профилактики определенных типов гриппа (обычно называемого гриппом). Вакцина работает, заставляя организм вырабатывать собственную защиту (антитела) против трех различных типов вируса гриппа.
Каждый год могут появляться новые типы вируса гриппа, поэтому каждый год в Инфлювак вносятся фрагменты вируса нового типа.Поэтому вакцинация против гриппа рекомендуется каждый год.
Обратите внимание, что Инфлювак защитит вас только от трех типов вируса гриппа, используемых для изготовления вакцины. Он не защитит вас от гриппа, вызванного другими типами вируса гриппа, или от инфекций, вызванных другими агентами, вызывающими гриппоподобные симптомы (например, простуду).
Грипп — инфекционное заболевание. Грипп распространяется мелкими каплями из носа, горла или рта инфицированного человека.Симптомы гриппа проявляются через 48 часов после контакта с вирусом. Они состоят из озноба, лихорадки, генерализованных болей и болей, головной боли и респираторных симптомов (боль в горле, насморк, кашель). Тяжесть и тип симптомов могут варьироваться. Большинство людей полностью выздоравливают в течение недели. Риск серьезных осложнений (например, пневмония и смерть) выше у очень молодых, очень старых и хронически больных людей.
Они состоят из озноба, лихорадки, генерализованных болей и болей, головной боли и респираторных симптомов (боль в горле, насморк, кашель). Тяжесть и тип симптомов могут варьироваться. Большинство людей полностью выздоравливают в течение недели. Риск серьезных осложнений (например, пневмония и смерть) выше у очень молодых, очень старых и хронически больных людей.
Инфлювак можно применять у взрослых и детей старше 6 месяцев.
Подробную информацию о рекомендациях по вакцинации против гриппа см. в соответствующем Национальном руководстве по иммунизации.
Инфлювак также может назначаться другим лицам, подверженным риску заражения гриппом.
Если у вас есть какие-либо вопросы, обратитесь к своему врачу.
ДО ПОЛУЧЕНИЯ ИНФЛЮВАКА
Не принимайте Инфлювак, если:
- у вас была аллергическая реакция на Инфлювак или любой ингредиент, содержащийся в этой вакцине.Ингредиенты перечислены в конце данной брошюры.

Признаки аллергической реакции могут включать зудящую кожную сыпь, одышку и отек лица или языка. - у вас была аллергическая реакция или вы почувствовали себя плохо после какой-либо другой противогриппозной вакцины (Флувакс, или Флуарикс, или Флувирин, или Ваксигрип)
- у вас аллергия на куриные белки, такие как яйца или перья
- у вас аллергия на гентамицин
- у вас есть тяжелая инфекция с высокой температурой
Легкая инфекция, такая как простуда, не должна быть проблемой, но перед вакцинацией поговорите об этом со своим врачом или медсестрой. - срок годности, указанный на упаковке, истек
- упаковка порвана или имеет следы вскрытия.
Поговорите со своим врачом или медсестрой, если вы не уверены, следует ли вам принимать Инфлювак.
Не передавайте эту вакцину никому другому.
Ваш врач прописал его специально для вас.
Перед применением Инфлювака
Сообщите своему врачу, если:
- у вас была аллергия на какие-либо другие лекарства, продукты питания, красители или консерванты
- вы уже принимали Инфлювак раньше и почувствовали недомогание, сообщите об этом своему врачу, медсестре или фармацевту раньше дана следующая доза
- вы беременны или собираетесь забеременеть.
 Ваш врач обсудит с вами преимущества и риски приема Инфлювак во время беременности
Ваш врач обсудит с вами преимущества и риски приема Инфлювак во время беременности - вы кормите грудью
Ваш врач обсудит риски и преимущества вакцинации, однако ожидается, что вакцина не вызовет проблем у детей, находящихся на грудном вскармливании - вы у вас когда-либо было заболевание, поражающее нервную систему, особенно синдром Гийена-Барре (СГБ)
Если у вас был СГБ, у вас может быть больше шансов заболеть СГБ после вакцинации против гриппа, чем у человека, который никогда не болел СГБ. - у вас есть какие-либо заболевания, такие как иммунодефицит или нарушение свертываемости крови.
Взаимодействие с другими лекарствами
Сообщите своему врачу, если вы принимаете какие-либо другие лекарства, в том числе те, которые вы покупаете без рецепта в аптеке, супермаркете или магазине диетических продуктов, или если вы получили другую вакцину.
КАК ВВОДИТСЯ ИНФЛЮВАК
Врач или медсестра введут Инфлювак в виде инъекции.
Поговорите со своим врачом, медсестрой или фармацевтом, если у вас есть сомнения по поводу того, как следует вводить эту вакцину.
Сколько вводится
Взрослые и дети старше 36 месяцев: 0,5 мл
Дети от 6 до 35 месяцев: 0,25 мл
Как вводится
Инъекцию можно вводить в мышцу плеча .
Некоторым людям с проблемами кровотечения может потребоваться введение инъекции под кожу (подкожно).
Инфлювак никогда не следует вводить внутривенно.
При введении
Инфлювак обычно вводят однократно каждый год осенью.
Некоторым людям, особенно людям с низким иммунитетом, и детям (в возрасте от 6 месяцев до 9 лет), которые впервые получают вакцину против гриппа, следует ввести вторую дозу через 4 недели после первой дозы. Однако одной дозы достаточно для большинства людей, особенно для тех, кто был вакцинирован против гриппа в прошлом году.
В случае пропуска дозы
Поговорите со своим врачом или медсестрой и как можно скорее договоритесь о повторном посещении.
ПОСЛЕ ПРИЕМА ИНФЛЮВАКА
На что следует обратить внимание
Будьте осторожны за рулем или работая с механизмами, пока не узнаете, как на вас влияет Инфлювак.
В норме Инфлювак не должен влиять на вашу способность управлять автомобилем или работать с механизмами. Но у некоторых людей вакцинация может вызвать головокружение или предобморочное состояние. Убедитесь, что вы знаете, как вы реагируете на Influvac, прежде чем водить машину, работать с механизмами или делать что-либо, что может быть опасным, если у вас кружится голова или кружится голова.
ПОБОЧНЫЕ ЭФФЕКТЫ
Как можно скорее сообщите своему врачу, медсестре или фармацевту, если вы чувствуете себя плохо во время или после приема дозы Инфлювак.
Инфлювак помогает защитить большинство людей от гриппа, но у некоторых людей он может вызывать нежелательные побочные эффекты. Все лекарства и вакцины могут иметь побочные эффекты. Иногда они серьезны; большую часть времени это не так. Некоторые побочные эффекты могут потребовать лечения.
Некоторые побочные эффекты могут потребовать лечения.
Попросите вашего врача, медсестру или фармацевта ответить на любые ваши вопросы.
Большинство нежелательных эффектов при приеме Инфлювака незначительны и обычно проходят в течение нескольких дней. Эти эффекты, как и в случае с другими вакцинами, обычно возникают вокруг места инъекции.
ЛЕГКИЕ ЯВЛЕНИЯ
Как можно скорее сообщите своему врачу, если заметите любое из следующего:
- покраснение, отек, уплотнение, болезненность, кровоподтеки или зуд вокруг места инъекции
- лихорадка, озноб , головная боль, недомогание (обычно плохое самочувствие)
- мышечные боли и боли
БОЛЕЕ СЕРЬЕЗНЫЕ ЭФФЕКТЫ, КОТОРЫЕ МОГУТ ПРОИЗОЙТИ РЕДКО
Как и в случае всех инъекционных вакцин, существует очень небольшой риск серьезной аллергической реакции.Немедленно сообщите своему врачу или обратитесь в отделение неотложной помощи в ближайшей больнице, если заметите любое из следующего:
- отек конечностей, лица, глаз, внутренней части носа, рта или горла
- одышка, затрудненное дыхание или трудности с глотанием
- крапивница, зуд (особенно рук или ног), покраснение кожи (особенно вокруг ушей) или тяжелые кожные реакции
- необычная усталость или слабость, которые являются внезапными и сильными.

Как и в случае всех инъекционных вакцин, существует очень небольшой риск таких реакций.Аллергия на Инфлювак встречается редко. Любые такие тяжелые реакции обычно возникают в течение первых нескольких часов после вакцинации.
Сообщите своему врачу, если вы заметите что-либо еще, из-за чего вы плохо себя чувствуете.
Другие побочные эффекты, не перечисленные выше, могут возникать во время или вскоре после введения дозы вакцины.
Не пугайтесь этого списка возможных побочных эффектов.
У вас может не быть ни одного из них.
ХРАНЕНИЕ
Инфлювак обычно хранится в аптеке, в поликлинике или хирургическом отделении.
Если вам необходимо хранить вакцину, всегда:
- Храните Инфлювак в холодильнике при температуре от +2°C до +8°C. УПАКОВКА НИКОГДА НЕ ДОЛЖНА БЫТЬ ЗАМОРОЖЕНА. ЗАМОРАЖИВАНИЕ УНИЧТОЖАЕТ ВАКЦИНУ.
- Храните вакцину в недоступном для детей месте.

- Храните Инфлювак в оригинальной упаковке, пока не придет время его давать.
Спросите своего фармацевта, что делать с остатками Influvac, срок годности которых истек или которые не были использованы.
ОПИСАНИЕ ПРОДУКТА
Внешний вид
Инфлювак — прозрачная бесцветная жидкость.
Упаковки по 1 или 10 предварительно заполненных (0,5 мл) стеклянных шприцев. AUST R 215555
Ингредиенты
Каждая доза Инфлювак 0,5 мл содержит три типа фрагментов вируса гриппа в забуференном фосфатом солевом растворе.
- штамм h2N1 15 мкг
- штамм h4N2 15 мкг
- штамм B 15 мкг
А: - калия хлорид, калия фосфат одноосновный, натрия фосфат двухосновный, натрия хлорид, кальция хлорид дигидрат, магния хлорид гексагидрат и вода для инъекций.
Вакцина также содержит ограниченное количество яичного белка, формальдегида, бромида цетримония, полисорбата 80 и гентамицина.
Influvac не производится с использованием человеческой крови или продуктов крови или каких-либо других веществ человеческого происхождения.
Спонсор
Influvac производится в Нидерландах для:
BGP Products Pty Ltd
Level 1, 30 The Bond
30-34 Hickson Road
Millers Point NSW 2000
Australia
This leaflet wasletter
Оценки эффективности вакцины против гриппа для конкретных брендов в сезоне 2019/20 в Европе – результаты исследовательской платформы DRIVE EU специфическая эффективность противогриппозной вакцины (IVE) для целей общественного здравоохранения и регулирования.Анализ и отчетность IVE проводятся государственными партнерами консорциума.
В 2019/20 г. четыре исследования с отрицательным дизайном (TND) на базе первичной медико-санитарной помощи (Австрия, Англия, Италия (n = 2)), восемь исследований TND на базе больниц (Финляндия, Франция, Италия, Румыния, Испания ( n = 4)) и одно популяционное когортное исследование (Финляндия). Пандемия COVID-19 затронула эпиднадзор за гриппом во всех участвовавших в исследовании центрах, поэтому период исследования был сокращен 29 февраля 2020 г. Стратифицировано по возрасту (6 мес.–17 лет, 18–64 лет, ≥65 лет), с поправкой на вмешивающиеся факторы, для конкретного места скорректированные оценки IVE были рассчитаны и объединены с помощью метаанализа .Была проведена экономная корректировка конфаундера, корректирующая оценки по возрасту, полу и календарному времени.
Стратифицировано по возрасту (6 мес.–17 лет, 18–64 лет, ≥65 лет), с поправкой на вмешивающиеся факторы, для конкретного места скорректированные оценки IVE были рассчитаны и объединены с помощью метаанализа .Была проведена экономная корректировка конфаундера, корректирующая оценки по возрасту, полу и календарному времени.
Исследования TND включали 3531 случай заболевания (351 вакцинированный) и 5546 контрольных случаев (1415 вакцинированных) всех возрастов. Оценки IVE были доступны для 8/11 брендов, продаваемых в Европе в 2019 г.
Большинство детей и взрослых < 64 лет были охвачены учреждениями первичной медико-санитарной помощи, и наиболее часто наблюдаемой маркой вакцины был Vaxigrip Tetra. Оценка против любого гриппа для Ваксигрип Тетра в учреждениях первичной медико-санитарной помощи составила 61% (95% ДИ 38–77) у детей и 32% (95% ДИ -13–59) у взрослых в возрасте до 64 лет.Большинство взрослых ≥ 65 лет были захвачены в больничных условиях, и наиболее часто наблюдаемым брендом был Fluad с оценкой 52% (95% ДИ 27–68).
Популяционная когорта охватила 511 854 человеко-лет и две марки вакцин. У детей в возрасте 2-6 лет ИВВ против любого гриппа составил 68% (95% ДИ 58-75) для Fluenz Tetra и 71% (56-80) для Vaxigrip Tetra. У взрослых ≥ 65 лет внутривенное введение против любого гриппа составило 29% (20–36) для Ваксигрип Тетра.
DRIVE — это растущая платформа. Учреждениям общественного здравоохранения, располагающим данными эпиднадзора, и больницам в странах с высоким охватом вакцинацией против гриппа предлагается присоединиться к DRIVE.
Хронология | История вакцин
История вакцин началась не с первой вакцины – использования Эдвардом Дженнером материала из пустул коровьей оспы для защиты от оспы. Скорее, он начинается с долгой истории инфекционных заболеваний у людей и, в частности, с раннего использования материала оспы для обеспечения иммунитета к этому заболеванию.
Существуют доказательства того, что китайцы применяли прививку от оспы (или вариоляцию, как называлось такое использование материала оспы) уже в 1000 г. н.э.Его практиковали также в Африке и Турции, прежде чем он распространился на Европу и Америку.
н.э.Его практиковали также в Африке и Турции, прежде чем он распространился на Европу и Америку.
Инновации Эдварда Дженнера, начатые им в 1796 году, когда он успешно использовал материал коровьей оспы для создания иммунитета к оспе, быстро сделали эту практику широко распространенной. Его метод претерпел медицинские и технологические изменения в течение следующих 200 лет и в конечном итоге привел к искоренению оспы.
Вакцина Луи Пастера от бешенства 1885 года была следующей, которая оказала влияние на болезни человека. А затем, на заре бактериологии, стремительно последовали разработки.Антитоксины и вакцины против дифтерии, столбняка, сибирской язвы, холеры, чумы, брюшного тифа, туберкулеза и других болезней были разработаны в 1930-х годах.
Середина 20 го века была активным временем для исследований и разработок вакцин. Методы выращивания вирусов в лаборатории привели к быстрым открытиям и инновациям, включая создание вакцин против полиомиелита. Исследователи сосредоточились на других распространенных детских заболеваниях, таких как корь, эпидемический паротит и краснуха, и вакцины от этих болезней значительно снизили бремя болезни.
Инновационные методы теперь стимулируют исследования вакцин, а технология рекомбинантной ДНК и новые методы доставки ведут ученых в новых направлениях. Цели в отношении болезней расширились, и некоторые исследования вакцин начинают сосредотачиваться на неинфекционных состояниях, таких как зависимость и аллергия.
Эти временные рамки охватывают не только науку, стоящую за вакцинами, но и культурные аспекты вакцинации, от раннего преследования вариолаторов оспы (см. влияние войн и социальных волнений на вакциноуправляемые заболевания.Эдвард Дженнер, Луи Пастер и Морис Хиллеман, пионеры в разработке вакцин, также получают особое внимание.
Эта категория временной шкалы содержит почти все записи для тематической временной шкалы. Некоторые записи были опущены, чтобы обеспечить общий обзор.
Путаница между вакциной против гриппа и вакциной против COVID-19
Теперь, когда вакцина против гриппа на 2021-2022 гг. 2019 (COVID-19) вакцины можно вводить во время одного визита, независимо от времени. Фактически, CDC рекомендует поставщикам медицинских услуг предлагать обе вакцины за одно посещение, чтобы повысить вероятность того, что люди будут полностью вакцинированы. Кроме того, в соответствии с разрешением на использование в чрезвычайных ситуациях (EUA) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) рекомендовало третью вакцину против COVID-19 для пациентов в возрасте 12 лет и старше с ослабленным иммунитетом от умеренной до тяжелой степени. Недавно FDA внесло поправки в EUA, включив бустерную вакцину Pfizer-BioNTech против COVID-19 для реципиентов вакцины Pfizer-BioNTech, которые завершили свою первоначальную серию как минимум 6 месяцев назад и в возрасте 65 лет или старше, или 18 лет или старше, если они живут в в учреждениях длительного ухода, имеют сопутствующие заболевания или если они живут или работают в условиях повышенного риска.
Фактически, CDC рекомендует поставщикам медицинских услуг предлагать обе вакцины за одно посещение, чтобы повысить вероятность того, что люди будут полностью вакцинированы. Кроме того, в соответствии с разрешением на использование в чрезвычайных ситуациях (EUA) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) рекомендовало третью вакцину против COVID-19 для пациентов в возрасте 12 лет и старше с ослабленным иммунитетом от умеренной до тяжелой степени. Недавно FDA внесло поправки в EUA, включив бустерную вакцину Pfizer-BioNTech против COVID-19 для реципиентов вакцины Pfizer-BioNTech, которые завершили свою первоначальную серию как минимум 6 месяцев назад и в возрасте 65 лет или старше, или 18 лет или старше, если они живут в в учреждениях длительного ухода, имеют сопутствующие заболевания или если они живут или работают в условиях повышенного риска.
Путаница между вакцинами против гриппа и COVID-19
К сожалению, с тех пор, как вакцина против гриппа стала доступна в сентябре 2021 года, ISMP получил несколько сообщений, в основном от потребителей, о путанице между вакциной против гриппа и вакциной против COVID-19. Большинство путаниц произошло у пациентов, которые согласились на вакцину против гриппа, но вместо этого получили одну из вакцин против COVID-19; однако в двух случаях пациенты получили вакцину против гриппа вместо предполагаемой вакцины против COVID-19. Все события произошли в аптеках внебольничной/амбулаторной помощи.Сообщенные случаи выделены ниже, и далее следует обсуждение возможных причинных факторов и рекомендуемых стратегий.
Большинство путаниц произошло у пациентов, которые согласились на вакцину против гриппа, но вместо этого получили одну из вакцин против COVID-19; однако в двух случаях пациенты получили вакцину против гриппа вместо предполагаемой вакцины против COVID-19. Все события произошли в аптеках внебольничной/амбулаторной помощи.Сообщенные случаи выделены ниже, и далее следует обсуждение возможных причинных факторов и рекомендуемых стратегий.
23-летний пациент получил вакцину Pfizer-BioNTech COVID-19 вместо вакцины против гриппа. После этого пациентку спросили, когда она получила первые две вакцины от COVID-19, и ошибка была признана. В то время как поставщик вакцины сообщил об ошибке и извинился перед пациентом, запрос пациента на получение вакцины против гриппа был вычеркнут и заменен на «COVID (3-й)» в документации, предоставленной пациенту.
17-летний подросток посетил местную аптеку за вакциной против гриппа, и ему по ошибке сделали прививку от COVID-19. В тот же вечер позвонили пациенту и сообщили об ошибке; однако родители пациента были расстроены, потому что они были против вакцины против COVID-19.
26-летний мужчина записался на прием в местную аптеку за вакциной против гриппа. По прибытии пациенту выдали форму для скрининга, форму согласия и информационный бюллетень о вакцине (VIS) для вакцины против гриппа.Однако вакцина против COVID-19 была введена по ошибке. Ошибка была немедленно обнаружена, и пациенту была сделана прививка от гриппа. Однако в аптеке пациентке не предоставили запись на третью вакцину от COVID-19.
Мать, сын (10 лет) и дочь (6 лет) получили вакцину Moderna COVID-19 вместо вакцины против гриппа. Когда у матери появились симптомы, похожие на те, которые она испытала после введения вакцин Moderna COVID-19, она позвонила фармацевту.После просмотра видео из клиники вакцинации фармацевт позвонила матери и сообщила, что она получила вакцину Moderna COVID-19 по ошибке, а ее дети получили вакцину против гриппа. После того, как у дочери развилась местная реакция в месте прививки, мать позвонила фармацевту и попросила его еще раз просмотреть видео. Через несколько дней фармацевт позвонил матери и сказал, что оба ее ребенка также получили вакцину от COVID-19 вместо вакцины против гриппа.
Через несколько дней фармацевт позвонил матери и сказал, что оба ее ребенка также получили вакцину от COVID-19 вместо вакцины против гриппа.
Вакцинированный 70-летний пациент получил вакцину Pfizer-BioNTech COVID-19 вместо вакцины против гриппа.Он заполнил форму согласия на вакцину против гриппа, но после введения ему сказали, что теперь у него есть «бустерная вакцина против COVID-19». Затем ему также сделали прививку от гриппа и попросили дать согласие на прививку от COVID-19, которую он получил по ошибке.
4-летний ребенок получил вакцину Pfizer-BioNTech COVID-19 вместо вакцины против гриппа. Вакцина Pfizer-BioNTech против COVID-19 не одобрена для EUA у 4-летнего ребенка. Хотя FDA в настоящее время рассматривает данные, представленные Pfizer-BioNTech в ходе исследования вакцины против COVID-19 у детей в возрасте 5–11 лет, доза намного меньше, чем та, которая используется для пациентов в возрасте 12 лет и старше.К счастью, ребенок не пострадал от вакцины.
22-летний пациент должен был получить свою первую дозу вакцины против COVID-19. Вакцинатор предположил, что пациент был там, чтобы получить вакцину против гриппа, и вместо этого ввел ее. Примерно через 20 минут после того, как пациент вышел из аптеки, ему позвонили и сообщили об ошибке. Неясно, вернулся ли пациент в аптеку, чтобы получить вакцину от COVID-19.
21-летний пациент должен был получить вакцину против COVID-19, но вместо этого получил вакцину против гриппа.До того, как ошибка была обнаружена, пациенту была выдана карта вакцинации против COVID-19. Позже пациентка заметила, что формы, которые она получила в аптеке, свидетельствовали о том, что она получила вакцину против гриппа. Вернулась в аптеку, где ошибка подтвердилась. Пациентка получила вакцину от COVID-19, но не извинилась за ошибку.
Пациент, который оказался фармацевтом, записался на прием в местной аптеке для получения вакцины против гриппа, а его жена записалась на прием одновременно для получения вакцины против гриппа и бустерной дозы Pfizer-BioNTech COVID-19 . Поскольку было большое количество пациентов, получающих бустерную дозу COVID-19, фармацевт попросил поставщика вакцин дважды проверить, что он получает только вакцину против гриппа (ранее он получил серию из двух вакцин Moderna COVID-19, для которых бустер еще не одобрен для EUA). После того, как поставщик вакцины подтвердил, что он вводил вакцину против гриппа, он схватил не тот шприц и по ошибке дал пациенту бустерную дозу вакцины Pfizer-BioNTech COVID-19.
Поскольку было большое количество пациентов, получающих бустерную дозу COVID-19, фармацевт попросил поставщика вакцин дважды проверить, что он получает только вакцину против гриппа (ранее он получил серию из двух вакцин Moderna COVID-19, для которых бустер еще не одобрен для EUA). После того, как поставщик вакцины подтвердил, что он вводил вакцину против гриппа, он схватил не тот шприц и по ошибке дал пациенту бустерную дозу вакцины Pfizer-BioNTech COVID-19.
Возможные причинные факторы
Поскольку о большинстве ошибок сообщают потребители, во многих случаях подробности о сопутствующих факторах не сообщаются.Однако возможные причинные факторы, которые мы почерпнули из отчетов, включают следующее:
Повышенный спрос и совместное введение вакцин. Сезон гриппа — это уже напряженное время для вакцинации в общественных аптеках. А с одобрением бустерной вакцины Pfizer-BioNTech и всплеском COVID-19 аптеки вынуждены еще больше удовлетворять спрос на услуги по вакцинации. Кроме того, причинным фактором может быть возможность введения вакцин против гриппа и COVID-19 во время одного визита.
Кроме того, причинным фактором может быть возможность введения вакцин против гриппа и COVID-19 во время одного визита.
Шприцы рядом друг с другом. Два поставщика вакцины указали, что они взяли шприц с вакциной против COVID-19 вместо шприца с вакциной против гриппа, которые находились рядом друг с другом в зоне вакцинации. Принесение обеих вакцин в зону вакцинации пациентов, когда в них нет необходимости, создает возможную путаницу для поставщика вакцин.
Немаркированные шприцы. В то время как многие поставщики вакцин покупают вакцину против гриппа в предварительно заполненных производителем шприцах с маркировкой, вакцины против COVID-19 доступны в многодозовых флаконах и должны быть подготовлены в шприце для введения пациентам.Возможно, эти подготовленные шприцы с вакциной против COVID-19 не были маркированы. Кроме того, дозы вакцины против COVID-19 могут быть приготовлены в немаркированном шприце одним поставщиком медицинских услуг, а введены другим; в результате лицо, вводящее вакцину, не может визуально проверить пустой флакон, если он остается у лица, приготовившего дозу.![]()
Отвлекающие факторы. После путаницы с вакциной один поставщик вакцин сказал пациенту, что его отвлек их разговор.Перебои и другие отвлекающие факторы в оживленной аптеке также могут привести к путанице.
Нехватка кадров. Поскольку большинство поставщиков медицинских услуг испытывают нехватку персонала, возможно, что нынешние поставщики вакцин выполняют несколько задач одновременно и торопятся/спешат, даже когда пациентам назначена вакцинация. Например, фармацевт, работавшая в одиночку в загруженной аптеке, недавно сообщила нам, что ей нужно сделать более 50 прививок за смену, помимо выдачи рецептов.
Рекомендации по технике безопасности
Внедряйте эти стратегии безопасности во время многоэтапного процесса вакцинации, чтобы избежать ошибок, особенно путаницы между вакцинами против гриппа и COVID-19:
Обеспечение кадровой поддержки. Запланируйте вакцинацию на выделенное время каждый день и обеспечьте адекватное укомплектование персоналом. В идеале не следует ожидать, что персонал будет одновременно выполнять функции по введению вакцины и регулярному ее распределению. Изучить использование квалифицированных и обученных добровольцев для оказания помощи в процессе вакцинации (как это было сделано изначально, когда вакцины против COVID-19 впервые стали доступны), чтобы снять часть стресса, связанного с нехваткой профессионального персонала.
В идеале не следует ожидать, что персонал будет одновременно выполнять функции по введению вакцины и регулярному ее распределению. Изучить использование квалифицированных и обученных добровольцев для оказания помощи в процессе вакцинации (как это было сделано изначально, когда вакцины против COVID-19 впервые стали доступны), чтобы снять часть стресса, связанного с нехваткой профессионального персонала.
Отдельные зоны вакцинации. Обеспечьте отдельное место для введения вакцины, вдали от отвлекающих факторов и отвлекающих факторов.
Промаркируйте шприцы. Все отдельные шприцы, содержащие вакцины, должны быть четко маркированы производителем, если используются предварительно заполненные шприцы, или специалистом по приготовлению дозы вакцины, если используются флаконы с однократной или многократной дозой. Не забудьте предоставить специалистам по приготовлению вакцин все необходимые этикетки для прикрепления к шприцам, чтобы облегчить надлежащую маркировку.
Разделите вакцины. Приносить в зону вакцинации только предназначенные и промаркированные шприцы для вакцины для одного пациента.
Определите пациента и запрошенную вакцину. Когда пациент подходит к стойке аптеки, чтобы запросить вакцинацию и непосредственно перед вакцинацией, попросите пациента предоставить как минимум два идентификатора пациента — его полное имя и дату рождения. Рекомендуется доступ к электронному профилю пациента для помощи в проверке личности пациента.Кроме того, не забудьте спросить пациента, какие вакцины он(а) запросил. Разговор с пациентом об их вакцинах перед введением может снизить риск ошибок. Обязательно сверяйте вакцины(ы), которые запрашивает пациент, с подписанной(ыми) формой(ами) согласия пациента.
Вовлеките пациента/родителя в процесс проверки. Попросите пациента/родителя прочитать этикетку шприца (и флакона, если он есть), чтобы убедиться, что это правильная вакцина. Попросите пациента/родителя и поставщика вакцины прочитать вслух этикетку и срок годности.Как минимум, поставщик вакцины должен сообщить пациенту, какая именно вакцина вводится до введения .
Попросите пациента/родителя и поставщика вакцины прочитать вслух этикетку и срок годности.Как минимум, поставщик вакцины должен сообщить пациенту, какая именно вакцина вводится до введения .
Номер партии документа/дата истечения срока действия. Задокументируйте номер партии вакцины и срок годности до введения. (Номер партии вакцины может сигнализировать о перепутывании и предотвратить ее попадание к пациенту.) Затем задокументируйте введение вакцины , а затем в профиле пациента, в записях о прививках, а также в государственных или других регистрах иммунизации.
Сканировать штрих-код. На этапе производства и/или проверки фармацевтом в процессе отпуска отсканируйте штрих-код вакцины, чтобы убедиться, что из холодильника или морозильной камеры извлечен правильный продукт. В идеале сканирование штрих-кода должно быть доступно в месте введения, даже в амбулаторных вакцинных клиниках, чтобы еще раз подтвердить, что была получена и приготовлена нужная вакцина.
Обеспечить предполагаемую вакцину. Если произошла путаница, извинитесь перед пациентом и предоставьте предполагаемую вакцину (поскольку вакцины против гриппа и COVID-19 могут быть введены в одно и то же посещение), либо до того, как они покинут зону вакцинации, либо попросив пациента вернуться к месту вакцинации.
Сообщить об ошибках вакцинации. Сообщайте обо всех ошибках вакцин внутри компании, а также в Систему отчетности о побочных эффектах вакцин (VAERS) FDA, которая является обязательной для ошибок с вакцинами против COVID-19, доступными в соответствии с EUA. ISMP также просит поставщиков сообщать об ошибках в вакцинах в Национальной программы отчетности об ошибках в вакцинах ISMP (ISMP VERP).
Санофи: Положительные результаты первого исследования высокодозированной противогриппозной вакцины с бустером мРНК COVID-19 поддерживают рекомендации по совместному введению бустерная поддержка рекомендации по совместному введению
- Первое исследование безопасности и иммуногенности обеих вакцин при совместном введении по сравнению с каждой вакциной, вводимой отдельно у взрослых в возрасте 65 лет и старше
- Своевременные новые данные для начала вакцинации против гриппа кампании в Северном полушарии
7 октября 2021
Промежуточные результаты первого описательного исследования совместного введения высокодозной четырехвалентной вакцины Fluzone ® Sanofi с экспериментальной бустерной дозой мРНК COVID-19 компании Moderna показывают, что введение вакцины во время одного и того же визита имели сходные i реакции иммуногенности и аналогичный профиль безопасности и переносимости по сравнению с каждой вакциной, вводимой по отдельности.
Fluzone ® High-Dose Quadrivalent — это высокодозированная четырехвалентная противогриппозная вакцина, показанная для взрослых в возрасте 65 лет и старше в США и Канаде. Он также лицензирован под торговой маркой Efluelda ® в Европе, где он показан взрослым в возрасте 60 лет и старше. Fluzone High-Dose — единственная вакцина против гриппа, которая продемонстрировала снижение осложнений, связанных с гриппом, таких как госпитализации из-за сердечно-сосудистых заболеваний и пневмонии, в течение 10 сезонов подряд у более чем 34 миллионов человек в возрасте 65 лет и старше 1 , 2 , 3 .
«В этом сезоне как никогда важно защитить пожилых людей, которые подвергаются особо высокому риску как тяжелого течения COVID-19, так и осложнений гриппа, которые могут включать сердечные приступы и инсульты , — говорит доктор . Майкл Гринберг, руководитель отдела вакцин в Северной Америке компании Sanofi. “ Это первое исследование, в котором представлены подтверждающие данные о вакцинации против гриппа одновременно с ревакцинацией мРНК COVID-19 у пожилых людей.Эти положительные результаты могут облегчить проведение кампаний по вакцинации против гриппа и COVID-19 в Северном полушарии кампаний, особенно среди этой группы высокого риска. ”
“ Это первое исследование, в котором представлены подтверждающие данные о вакцинации против гриппа одновременно с ревакцинацией мРНК COVID-19 у пожилых людей.Эти положительные результаты могут облегчить проведение кампаний по вакцинации против гриппа и COVID-19 в Северном полушарии кампаний, особенно среди этой группы высокого риска. ”
Эти обнадеживающие результаты подкрепляют существующие во всем мире рекомендации по совместному администрированию. Одновременное использование вакцин против COVID-19 и вакцин против гриппа в настоящее время разрешено в нескольких странах 4 , включая США 5 , Францию 6 , Великобританию 7 и Германию 8 .
Об исследовании
Это описательное исследование проводится в Соединенных Штатах, и в настоящее время за участниками в течение 6 месяцев наблюдают в целях безопасности. В него вошли около 300 участников в возрасте 65 лет и старше, которые получили две дозы мРНК-вакцины COVID-19 в качестве первичной вакцинации не менее чем за пять месяцев до регистрации. В исследовании оценивается профиль безопасности и иммунный ответ при одновременном введении экспериментальной ревакцинации мРНК COVID-19 (доза 100 мкг) и четырехвалентной противогриппозной вакцины в высоких дозах.Полные результаты исследования будут опубликованы позже в этом году.
В него вошли около 300 участников в возрасте 65 лет и старше, которые получили две дозы мРНК-вакцины COVID-19 в качестве первичной вакцинации не менее чем за пять месяцев до регистрации. В исследовании оценивается профиль безопасности и иммунный ответ при одновременном введении экспериментальной ревакцинации мРНК COVID-19 (доза 100 мкг) и четырехвалентной противогриппозной вакцины в высоких дозах.Полные результаты исследования будут опубликованы позже в этом году.
Исследование спонсируется компанией Sanofi в партнерстве с Управлением перспективных биомедицинских исследований и разработок (BARDA), входящим в состав офиса помощника секретаря по вопросам готовности и реагирования Министерства здравоохранения и социальных служб США, а также с Moderna.
Вакцина мРНК COVID-19 (вакцина мРНК-1273, 100 мкг), оцениваемая в этом исследовании, производится компанией Moderna и вводится в качестве бустерной дозы в дозе 100 мкг.Участники исследования ранее получали первичную серию вакцины Moderna против COVID-19 (две дозы) не менее чем за пять месяцев до зачисления. Заявка Moderna на бустерную терапию в настоящее время находится на рассмотрении FDA США.
Заявка Moderna на бустерную терапию в настоящее время находится на рассмотрении FDA США.
Около Около FLUZONE ® Высокодонад. / EFLUELDA ®
®Fluzone® High-Doze Quadrisentent — это высокодозная вакцина против высокой дозы вакцина на гриппе, указанная для взрослых в возрасте 65 лет и старше в Северной Америке.Он также лицензирован под торговой маркой Efluelda® в Европе, где он показан взрослым в возрасте 60 лет и старше.
Эта высокодозированная противогриппозная вакцина была впервые разработана и лицензирована в трехвалентной форме в США в 2009 г. для людей в возрасте 65 лет и старше. Данные для трехвалентной композиции переносятся на четырехвалентную после завершения исследования иммуногенности 9 , 10 .
Эта противогриппозная вакцина с высокими дозами является первой и единственной противогриппозной вакциной, для которой доказано превосходство над стандартной противогриппозной вакциной для профилактики гриппа у взрослых 65 лет и старше 11 , 12 -группа риска по тяжелому течению COVID-19 и гриппу. Эта вакцина продемонстрировала защиту не только от гриппа, но и снижение связанных с гриппом осложнений, таких как госпитализации из-за сердечно-сосудистых заболеваний и пневмонии, в течение 10 сезонов гриппа у более чем 34 миллионов человек в возрасте 65 лет и старше 1 , 13 .
Эта вакцина продемонстрировала защиту не только от гриппа, но и снижение связанных с гриппом осложнений, таких как госпитализации из-за сердечно-сосудистых заболеваний и пневмонии, в течение 10 сезонов гриппа у более чем 34 миллионов человек в возрасте 65 лет и старше 1 , 13 .
О Санофи
Санофи стремится поддерживать людей в решении их проблем со здоровьем. Мы глобальная биофармацевтическая компания, ориентированная на здоровье человека.Мы предотвращаем болезни с помощью вакцин, предлагаем инновационные методы лечения боли и облегчения страданий. Мы поддерживаем тех немногих, кто страдает редкими заболеваниями, и миллионы людей с хроническими заболеваниями.
Санофи, насчитывающая более 100 000 сотрудников в 100 странах, трансформирует научные инновации в решения для здравоохранения по всему миру.
Контактное лицо по связям со СМИ
Салли Бейн
Тел. : +1 (781) 264 1091
: +1 (781) 264 1091
Салли[email protected]
Investor Отношения контакты PARIS
EVA Schaefer-Jansen
Arnaud Delepine
Nathalie Pham
Инвесторные отношения Контакты Северная Америка
Felix Lauscher
тел.: +33 (0) 1 53 77 45 45
[email protected]
https://www.sanofi.com/en/investors/contact
Прогнозные заявления Санофи
Настоящий пресс-релиз содержит прогнозные заявления, как они определены в Закон о реформе судебного разбирательства по частным ценным бумагам 1995 г. с поправками.Прогнозные заявления — это заявления, которые не являются историческими фактами. Эти заявления включают прогнозы и оценки в отношении маркетингового и другого потенциала продукта или в отношении потенциальных будущих доходов от продукта. Прогнозные заявления обычно обозначаются словами «ожидает», «предвидит», «полагает», «намеревается», «оценивает», «планирует» и подобными выражениями. Хотя руководство Санофи считает, что ожидания, отраженные в таких прогнозных заявлениях, являются разумными, инвесторы предупреждены о том, что прогнозная информация и заявления подвержены различным рискам и неопределенностям, многие из которых трудно предсказать и которые, как правило, находятся вне контроля Санофи. которые могут привести к тому, что фактические результаты и события будут существенно отличаться от тех, которые выражены, подразумеваются или прогнозируются в прогнозной информации и заявлениях.Эти риски и неопределенности включают, среди прочего, неожиданные действия или задержки регулирующих органов или государственное регулирование в целом, которые могут повлиять на доступность или коммерческий потенциал продукта, тот факт, что продукт может быть коммерчески неуспешным, неопределенности, присущие исследованиям и разработкам, включая будущие клинические данные и анализ существующих клинических данных, относящихся к продукту, включая постмаркетинговые, непредвиденные проблемы с безопасностью, качеством или производством, конкуренцию в целом, риски, связанные с интеллектуальной собственностью, и любые связанные будущие судебные разбирательства и окончательный исход таких судебных разбирательств, а также нестабильные экономические и рыночные условия, а также влияние, которое COVID-19 окажет на нас, наших клиентов, поставщиков, продавцов и других деловых партнеров, а также на финансовое состояние любого из них, а также на наших сотрудников и на глобальную экономика в целом.
Хотя руководство Санофи считает, что ожидания, отраженные в таких прогнозных заявлениях, являются разумными, инвесторы предупреждены о том, что прогнозная информация и заявления подвержены различным рискам и неопределенностям, многие из которых трудно предсказать и которые, как правило, находятся вне контроля Санофи. которые могут привести к тому, что фактические результаты и события будут существенно отличаться от тех, которые выражены, подразумеваются или прогнозируются в прогнозной информации и заявлениях.Эти риски и неопределенности включают, среди прочего, неожиданные действия или задержки регулирующих органов или государственное регулирование в целом, которые могут повлиять на доступность или коммерческий потенциал продукта, тот факт, что продукт может быть коммерчески неуспешным, неопределенности, присущие исследованиям и разработкам, включая будущие клинические данные и анализ существующих клинических данных, относящихся к продукту, включая постмаркетинговые, непредвиденные проблемы с безопасностью, качеством или производством, конкуренцию в целом, риски, связанные с интеллектуальной собственностью, и любые связанные будущие судебные разбирательства и окончательный исход таких судебных разбирательств, а также нестабильные экономические и рыночные условия, а также влияние, которое COVID-19 окажет на нас, наших клиентов, поставщиков, продавцов и других деловых партнеров, а также на финансовое состояние любого из них, а также на наших сотрудников и на глобальную экономика в целом. Любое существенное влияние COVID-19 на любое из вышеперечисленных действий также может негативно сказаться на нас. Эта ситуация быстро меняется и могут возникнуть дополнительные воздействия, о которых мы в настоящее время не знаем, и которые могут усугубить другие ранее выявленные риски. Риски и неопределенности также включают неопределенности, обсуждаемые или идентифицированные в публичных документах Санофи в SEC и AMF, в том числе те, которые перечислены в разделах «Факторы риска» и «Предостережение относительно прогнозных заявлений» в годовом отчете Санофи по форме 20. -F за год, закончившийся 31 декабря 2020 г.За исключением случаев, предусмотренных применимым законодательством, Санофи не берет на себя никаких обязательств по обновлению или пересмотру какой-либо прогнозной информации или заявлений.
Любое существенное влияние COVID-19 на любое из вышеперечисленных действий также может негативно сказаться на нас. Эта ситуация быстро меняется и могут возникнуть дополнительные воздействия, о которых мы в настоящее время не знаем, и которые могут усугубить другие ранее выявленные риски. Риски и неопределенности также включают неопределенности, обсуждаемые или идентифицированные в публичных документах Санофи в SEC и AMF, в том числе те, которые перечислены в разделах «Факторы риска» и «Предостережение относительно прогнозных заявлений» в годовом отчете Санофи по форме 20. -F за год, закончившийся 31 декабря 2020 г.За исключением случаев, предусмотренных применимым законодательством, Санофи не берет на себя никаких обязательств по обновлению или пересмотру какой-либо прогнозной информации или заявлений.
1 Chang LJ, et al. (2019). Безопасность и иммуногенность высоких доз четырехвалентной вакцины против гриппа у взрослых в возрасте ≥65 лет: рандомизированное клиническое исследование фазы 3. вакцина. 2019 16 сентября; 37 (39): 5825-5834. doi: 10.1016/j.vaccine.2019.08.016.
вакцина. 2019 16 сентября; 37 (39): 5825-5834. doi: 10.1016/j.vaccine.2019.08.016.
2 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).(2020). Вкладыш в упаковку – Четырехвалентный препарат с высокой дозой Fluzone. Санофи Пастер. Доступно по ссылке: https://www.fda.gov/media/132238/download. По состоянию на май 2020 г.
3 JK H Lee, GKL Lam, T. Shin et al, Эффективность и действенность высокодозированной противогриппозной вакцины у пожилых людей в зависимости от циркулирующего штамма и антигенного соответствия: обновленный системный обзор и метаанализ, Vaccine , https://doi.org/10.1016/j.vaccine.2020.09.004
4 По состоянию на 30 сентября th : Австрия, Бельгия, Канада, Дания, Эстония, Финляндия, Франция, Германия, Ирландия, Латвия, Швейцария, Великобритания и США
5 CDC США.Временные клинические рекомендации по использованию вакцин против COVID-19, разрешенных в настоящее время в США (обновлено 14 мая) 2021 г.__INFLUVAC.jpg) По состоянию на июнь 2021 г.
По состоянию на июнь 2021 г.
6 Haute Autorité de Santé. Avis n° 2021.0069/AC/SESPEV от 23 сентября 2021 г. Высшего колледжа
Autorité de santé venant compléter l’avis du 23 августа 2021 г., относящийся к определению населения, а также cibler
par la campagne de rappel vaccinance les yez полная первичная вакцинация против
Covid-19.2021; https://www.has-sante.fr/jcms/p_3288556/fr/avis-n-2021-0069/ac/sespev-du-23-
septembre-2021-du-college-de-la-haute-autorite -de-sante-venant-completer-l-avis-du-23-aout-2021-
relatif-a-la-definition-des-populations-a-cibler-par-la-campagne-de-rappel-vaccinal- chez-les-personnesayant-eu-une-primovaccation-complete-contre-la-covid-19. Дата обращения 30.09.2021.
7 Объединенный комитет по вакцинации и иммунизации (ОКВИ). Заявление JCVI о программе ревакцинации COVID-19 на зиму 2021–2022 гг.2021; https://www.gov.uk/government/publications/jcvi-statement-september-2021-covid-19-booster-vaccine-programme-for-winter-2021-to-2022/jcvi-statement-regarding-a- covid-19-booster-vaccine-programme-for-winter-2021-to-2022#:~:text=In%20JCVI%20%20view%2C%20the и%20to%20protect%20%20NHS.![]() Дата обращения 17.09.2021.
Дата обращения 17.09.2021.
8 Постоянный комитет по вакцинации (STIKO) Германия. STIKO-Empfehlung zur COVID-19-Impfung. 2021; https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/39/Art_01.html;jsessionid=3D09AE10507D6 3C7D0E8BEA75C7986BD.internet102. Проверено 27.09.2021.
9 Chang LJ, et al. (2019). Безопасность и иммуногенность высоких доз четырехвалентной вакцины против гриппа у взрослых в возрасте ≥65 лет: рандомизированное клиническое исследование фазы 3. вакцина. 2019 16 сентября; 37 (39): 5825-5834. doi: 10.1016/j.vaccine.2019.08.016.
10 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). (2020). Вкладыш в упаковку – Четырехвалентный препарат с высокой дозой Fluzone. Санофи Пастер. Доступно по адресу: https://www.fda.gov/media/132238/download. По состоянию на май 2020 г.
11 Diaz Granados CA, Dunning AJ, Kimmel M, et al. Эффективность высокодозовой противогриппозной вакцины по сравнению со стандартной дозой у пожилых людей. N Engl J Med 2014; 371: 635-645
N Engl J Med 2014; 371: 635-645
12 Chang L-J, Meng Y, Janosczyk H, et al. Безопасность и иммуногенность высоких доз четырехвалентной вакцины против гриппа у взрослых в возрасте ≥65 лет: рандомизированное клиническое исследование фазы 3. Вакцина 2019; 37: 5825-5834
13 Дж. К. Х. Ли, Г. К. Л. Лам, Т.Шин и др., Эффективность и действенность высокодозированной противогриппозной вакцины у пожилых людей в зависимости от циркулирующего штамма и антигенного соответствия: обновленный системный обзор и метаанализ, Вакцина, https://doi.org/10.1016/j.vaccine.2020.09. 004
Современные и перспективные технологии производства клеточных культур для вакцин против гриппа
Ежегодно вирус гриппа поражает миллионы людей во всем мире.Программы вакцинации против сезонных инфекций гриппа требуют производства сотен миллионов доз в течение очень короткого периода времени. Вакцина против гриппа в настоящее время производится с использованием технологии, разработанной в 1940-х годах и основанной на репликации вируса в куриных яйцах с эмбрионами. Препарат моновалентного вируса инактивируют и очищают перед введением в состав трехвалентной или четырехвалентной противогриппозной вакцины. Производственный процесс зависел от непрерывной поставки яиц. В случае вспышек пандемии этот способ производства может быть проблематичным из-за возможного резкого сокращения предложения яиц и низкой гибкости производственного процесса, что приводит к отсутствию своевременных поставок необходимых доз вакцины.Появились новые системы производства с использованием культур клеток млекопитающих или насекомых, чтобы преодолеть ограничения системы производства на основе яиц. Эти промышленно хорошо зарекомендовавшие себя производственные системы были выбраны в первую очередь для более быстрого и гибкого реагирования на угрозы пандемии. Здесь мы рассмотрим наиболее важные процессы производства клеточных культур, которые были разработаны в последние годы для массового производства вакцин против гриппа.
Препарат моновалентного вируса инактивируют и очищают перед введением в состав трехвалентной или четырехвалентной противогриппозной вакцины. Производственный процесс зависел от непрерывной поставки яиц. В случае вспышек пандемии этот способ производства может быть проблематичным из-за возможного резкого сокращения предложения яиц и низкой гибкости производственного процесса, что приводит к отсутствию своевременных поставок необходимых доз вакцины.Появились новые системы производства с использованием культур клеток млекопитающих или насекомых, чтобы преодолеть ограничения системы производства на основе яиц. Эти промышленно хорошо зарекомендовавшие себя производственные системы были выбраны в первую очередь для более быстрого и гибкого реагирования на угрозы пандемии. Здесь мы рассмотрим наиболее важные процессы производства клеточных культур, которые были разработаны в последние годы для массового производства вакцин против гриппа.
1. Введение
Вирус гриппа ежегодно вызывает глобальную эпидемию, поражающую миллионы людей и вызывающую серьезные заболевания и смерть во всем мире. В Соединенных Штатах заражение вирусами гриппа приводит к кумулятивной частоте госпитализаций 35,5 на 100 000 человек, в основном пожилым людям (88,1 на 100 000 населения) или очень молодым людям (46,7 на 100 000 населения) со 107 смертями, связанными с гриппом у детей (http http://www.cdc.gov/). Вакцинация остается основной и наиболее эффективной стратегией профилактики и борьбы с гриппом.
В Соединенных Штатах заражение вирусами гриппа приводит к кумулятивной частоте госпитализаций 35,5 на 100 000 человек, в основном пожилым людям (88,1 на 100 000 населения) или очень молодым людям (46,7 на 100 000 населения) со 107 смертями, связанными с гриппом у детей (http http://www.cdc.gov/). Вакцинация остается основной и наиболее эффективной стратегией профилактики и борьбы с гриппом.
Три рода вирусов гриппа (A, B и C) восприимчивы к заражению человека.Вирус гриппа представляет собой сегментированный геном с отрицательной цепью РНК семейства Orthomyxoviridae. Восемь сегментов РНК генома гриппа А и В кодируют вирусные белки: PB1, PB2, PA, M1, M2, NS NA, HA и NP [1]. Недавно были описаны новые дополнительные белки гриппа, такие как PB1-F2 [2], PB1-N40 [3], PA-X [4], PA-N155 и PA-N182 [5].
Вирус гриппа А подразделяется на подтипы на основе наиболее распространенных поверхностных антигенов: гемагглютинина (НА) и нейраминидазы (НА).На сегодняшний день идентифицировано семнадцать различных подтипов гликопротеина HA и девять NA [6]. Для вируса гриппа B определен только один подтип; однако были идентифицированы две антигенно разные линии, Yamagata и Victoria [7].
Для вируса гриппа B определен только один подтип; однако были идентифицированы две антигенно разные линии, Yamagata и Victoria [7].
Вирионы гриппа постоянно изменяют аминокислотную последовательность белков HA и NA, чтобы избежать иммунологического контроля хозяина [8] путем точечных мутаций в последовательности белков (антигенный дрейф) или путем обмена РНК вируса HA и NA от другого вируса гриппа подтип, заразивший того же хозяина (антигенный шифт) [9, 10].В процессе реассортации образуется новый вирус, кодирующий совершенно новые антигенные белки, что может привести к пандемии, если человеческая популяция иммунологически невосприимчива к новому вирусу.
Из-за высокой частоты мутаций вируса гриппа производители вакцин должны каждый год изменять рецептуру своих продуктов, чтобы обеспечить хорошее соответствие между HA и NA, присутствующими в вакцине, и циркулирующим штаммом [11]. Наиболее распространенные вакцины против сезонного гриппа сочетают в себе антигены, полученные из трех циркулирующих штаммов гриппа: двух штаммов, h2 и h4, для гриппа A и одного штамма для гриппа B, в соответствии с рекомендациями ВОЗ для каждого сезона в Северном и Южном полушариях (http:/ /www. who.int/influenza/en/). Существует два типа противогриппозных вакцин: инактивированные противогриппозные вакцины и живые аттенуированные противогриппозные вакцины (ЖГВ). Наиболее распространенным составом вакцины против сезонного гриппа является трехвалентная инактивированная вакцина (ТИВ) с 15 мкг г каждого компонента. Среди инактивированных гриппозных вакцин выделяют три типа: цельновирусные, сплит-вирусные и субъединичные [12, 13].
who.int/influenza/en/). Существует два типа противогриппозных вакцин: инактивированные противогриппозные вакцины и живые аттенуированные противогриппозные вакцины (ЖГВ). Наиболее распространенным составом вакцины против сезонного гриппа является трехвалентная инактивированная вакцина (ТИВ) с 15 мкг г каждого компонента. Среди инактивированных гриппозных вакцин выделяют три типа: цельновирусные, сплит-вирусные и субъединичные [12, 13].
Чтобы повысить эффективность своих вакцин, ряд производителей вакцин разработали составы четырехвалентных гриппозных вакцин для сезонной вакцинации, включив в них обе линии гриппа В.Недавно Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило четырехвалентную формулу, в которую добавлен дополнительный штамм гриппа B [14].
Большинство имеющихся в настоящее время лицензированных противогриппозных вакцин производится с использованием куриных яиц с эмбрионами (таблицы 1 и 2) и системы производства, созданной в 1940-х годах. Оплодотворенные куриные яйца используют в качестве параллельно работающих минифабрик по репликации вируса гриппа [15]. Как инактивированные, так и ЖГВ вакцины имеют схожие этапы производственного процесса на основе яиц.Целый вирус ЖГВ выделяют и дополнительно очищают [16]. В 2003 г. FDA одобрило коммерциализацию FluMist (MedImmune), первой трехвалентной противогриппозной вакцины с живым аттенуированным вирусом [16–18]. Однако важно отметить, что ЖГВ используются в России почти 30 лет [19, 20].
Оплодотворенные куриные яйца используют в качестве параллельно работающих минифабрик по репликации вируса гриппа [15]. Как инактивированные, так и ЖГВ вакцины имеют схожие этапы производственного процесса на основе яиц.Целый вирус ЖГВ выделяют и дополнительно очищают [16]. В 2003 г. FDA одобрило коммерциализацию FluMist (MedImmune), первой трехвалентной противогриппозной вакцины с живым аттенуированным вирусом [16–18]. Однако важно отметить, что ЖГВ используются в России почти 30 лет [19, 20].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Производственная система на основе яиц была использована более 60 лет, и это по-прежнему является наиболее широко используемым методом для получения 500 миллионов вакцин. дозы ne (оценка по Партриджу и Киени [21]).Повышенный спрос и угроза вспышки пандемии ускорили внедрение новых производственных стратегий производства вакцины против гриппа. В случае пандемии системы производства яиц может оказаться недостаточно для удовлетворения глобального спроса из-за наличия яиц. Средний предполагаемый выход вакцины на яичной основе составляет одну дозу вакцины на одно-два яйца. Учитывая текущую производственную мощность, оцениваемую в 1420 млн доз [21], необходимо увеличить ее в 1 раз.5 текущая способность снабжать население мира в течение 1 года. Такая повышенная мощность кажется неосуществимой с системой на основе яиц [18]. Поэтому, вызванные планами готовности к пандемии в различных западных странах, несколько систем экспрессии и производственных процессов были оценены как альтернативы методам производства на основе яиц. Например, Служба здравоохранения США через Агентство передовых биомедицинских исследований и разработок (BARDA) активно поддерживала разработку альтернативных стратегий производства вакцин против гриппа.
дозы ne (оценка по Партриджу и Киени [21]).Повышенный спрос и угроза вспышки пандемии ускорили внедрение новых производственных стратегий производства вакцины против гриппа. В случае пандемии системы производства яиц может оказаться недостаточно для удовлетворения глобального спроса из-за наличия яиц. Средний предполагаемый выход вакцины на яичной основе составляет одну дозу вакцины на одно-два яйца. Учитывая текущую производственную мощность, оцениваемую в 1420 млн доз [21], необходимо увеличить ее в 1 раз.5 текущая способность снабжать население мира в течение 1 года. Такая повышенная мощность кажется неосуществимой с системой на основе яиц [18]. Поэтому, вызванные планами готовности к пандемии в различных западных странах, несколько систем экспрессии и производственных процессов были оценены как альтернативы методам производства на основе яиц. Например, Служба здравоохранения США через Агентство передовых биомедицинских исследований и разработок (BARDA) активно поддерживала разработку альтернативных стратегий производства вакцин против гриппа. Одним из предпочтительных вариантов является использование клеточной культуры для производства вакцин. В отличие от производственных процессов, основанных на яйце, технология клеточного производства позволяет производителям быстрее реагировать на потребности рынка и в более короткие производственные циклы, а также обеспечивает большую производительность, лучший контроль процесса и более надежный и хорошо изученный продукт. Производство на основе клеток позволяет производителям поставлять большее количество вакцин за более короткий промежуток времени [22–24]. При этом вирус, полученный в культурах клеток, имеет большее сходство с циркулирующими штаммами, в отличие от вируса, продуцируемого в яйцах, которые могут иметь антигенные модификации [25–27].Еще одним преимуществом отказа от использования яиц для производства вакцин является отказ от компонентов яйца, которые могут вызывать аллергические реакции [28]. Кроме того, клеточную культуру можно использовать для получения вирусных семян, что позволяет избежать длительного и громоздкого соответствующего процесса в яйцах [11].
Одним из предпочтительных вариантов является использование клеточной культуры для производства вакцин. В отличие от производственных процессов, основанных на яйце, технология клеточного производства позволяет производителям быстрее реагировать на потребности рынка и в более короткие производственные циклы, а также обеспечивает большую производительность, лучший контроль процесса и более надежный и хорошо изученный продукт. Производство на основе клеток позволяет производителям поставлять большее количество вакцин за более короткий промежуток времени [22–24]. При этом вирус, полученный в культурах клеток, имеет большее сходство с циркулирующими штаммами, в отличие от вируса, продуцируемого в яйцах, которые могут иметь антигенные модификации [25–27].Еще одним преимуществом отказа от использования яиц для производства вакцин является отказ от компонентов яйца, которые могут вызывать аллергические реакции [28]. Кроме того, клеточную культуру можно использовать для получения вирусных семян, что позволяет избежать длительного и громоздкого соответствующего процесса в яйцах [11].
С другой стороны, производство противогриппозной вакцины с использованием клеточной культуры имеет некоторые недостатки. Клетки должны быть свободны от постороннего вируса, а выход вируса может быть низким [11, 29], что требует большего скрининга клеточных линий и значительной интенсификации процесса.
Этот обзор посвящен различным типам одобренных в настоящее время противогриппозных вакцин, производимых на клеточных культурах, а также новым подходам к разработке противогриппозных вакцин-кандидатов, производимых с использованием технологий клеточных культур.
2. Логистические проблемы и критические сроки производства вакцины против гриппа
2.1. Эпиднадзор и создание семенных запасов вирусов
Состав вакцины против сезонного гриппа основан на системе эпиднадзора за циркуляцией вируса гриппа (http://who.int/influenza/gisrs_laboratory/en/) (http://www.influenzacentre.org/centre_GISRS.htm). Должностные лица ВОЗ сотрудничают с национальными агентствами здравоохранения для выявления циркулирующих штаммов, которые преобладали в течение предыдущего сезона вакцинации и которые могут вызвать грипп следующей зимой в Северном и Южном полушариях.
Национальный центр гриппа проводит выделение вируса из определенных образцов, полученных от пациентов, чтобы определить, растет ли вирус в культуре.Выделение вируса осуществляется с использованием клеток млекопитающих, таких как клетки почки собаки Madin Darby (MDCK), вместо использования яиц с эмбрионами, как это проводилось в прошлом [11]. Более высокие скорости выделения были получены с использованием клеток MDCK, а не яиц, особенно для штамма h4N2 [30–32]. Вирус идентифицируют с помощью реагентов, предоставленных Сотрудничающими центрами ВОЗ. Репрезентативные образцы отправляются для более подробного изучения в один из сотрудничающих центров справочной информации и исследований по гриппу в Лондоне (Национальный институт медицинских исследований), Атланте (Центры по контролю за заболеваниями), Мельбурне (Сотрудничающий центр ВОЗ по справочной информации и исследованиям гриппа). ), Токио (Национальный институт инфекционных заболеваний), Мемфис (Сотрудничающий центр ВОЗ по изучению экологии гриппа у животных) и Пекин (Сотрудничающий центр ВОЗ по справочным материалам и исследованиям гриппа).
Посевные штаммы получены путем генетической реассортации в трех лабораториях с использованием вирусов сезонного гриппа h2N1 и h4N2, предоставленных Центрами сотрудничества ВОЗ [33]. Таким образом, отобранные сезонные штаммы объединяют со штаммом h2N1/A/PR/8/34, который дает высокие урожаи в яйцах с эмбрионами [34]. Традиционный метод получения реассортантного вируса основан на коинфекции двух штаммов в яйцах. Альтернативным методом получения реассортантных вирусов является обратная генетика.Были разработаны различные подходы к обратной генетике, но это метод, основанный на клеточных культурах, который использует плазмидную ДНК отдельно с вспомогательным вирусом или без него [35–37] для создания реассортантных вирусов. Недавно были опубликованы прекрасные обзоры по обратной генетике [38, 39]. Использование обратной генетики может упростить процесс создания реассортантных вирусов и стать лучшей альтернативой громоздкому процессу создания реассортантного вируса путем коинфекции яиц [18]. Недавно для получения реассортанта вируса H5N1 была использована обратная генетика [40, 41].
Недавно для получения реассортанта вируса H5N1 была использована обратная генетика [40, 41].
Реассортантный вирус затем распространяется среди всех производителей для начала их производственных кампаний по вакцинам против сезонного гриппа. Хотя большую часть рабочего материала для эпиднадзора получают из клеточных изолятов, эти выделенные вирусы нельзя использовать для производства вакцины против сезонного гриппа, поскольку вирус-предшественник посевного материала должен генерироваться в яйцах в соответствии с действующими нормами [33, 42].Сообщалось, что, хотя штамм вируса гриппа выделяется из клеточной культуры на этапе эпиднадзора, он может быть повторно изолирован в яйцах для получения посевного материала вируса, который будет распространяться среди производителей. Однако, если производитель использует технологию культивирования клеток, вирус может быть реадаптирован de novo для роста в клетках млекопитающих. Это может добавить значительные дополнительные задержки в сроки производства клеточных культур [43].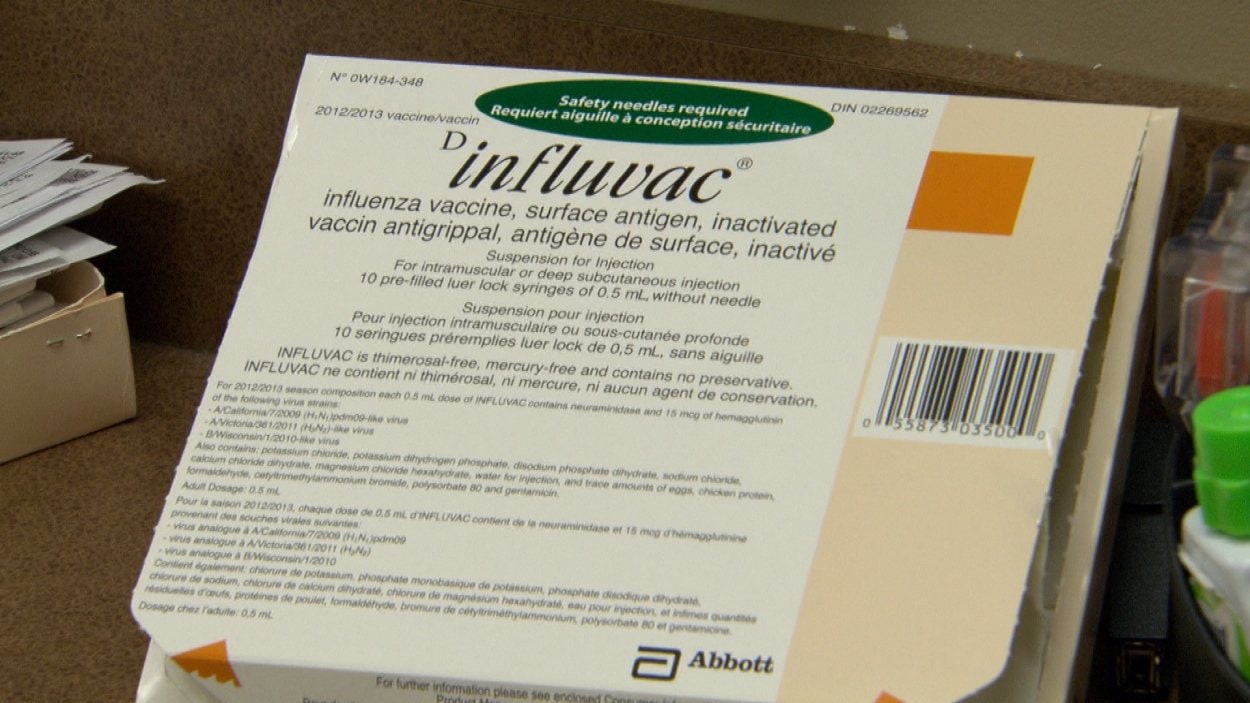 Ожидается, что по мере накопления дополнительных данных о безопасности производство вирусных семян будет более упорядоченным и интегрированным в производство вакцин против гриппа на клеточных культурах.
Ожидается, что по мере накопления дополнительных данных о безопасности производство вирусных семян будет более упорядоченным и интегрированным в производство вакцин против гриппа на клеточных культурах.
2.2. График производства обычных вакцин
Производство вакцины против сезонного гриппа представляет собой огромную проблему для производителей, поскольку с того момента, как ВОЗ объявляет сезонные штаммы в феврале для Северного полушария и в сентябре для Южного полушария, для производителей доступно только 6-месячное окно. разработать и поставить вакцины в июле-августе для начала кампании вакцинации в сентябре в Северном полушарии и в марте для начала в апреле в Южном полушарии (рис. 1).
На сроки могут повлиять несколько факторов. Одним из факторов является рост вируса, а вторым фактором является выполнение всех регулирующих аспектов [44]. Эти регуляторные аспекты включают контроль жизнеспособного вируса гриппа, определение содержания HA и присутствия NA, тестирование эффективного разрушения вируса, содержания эндотоксина и общего белка, а также выполнение тестов на стерильность и стабильность готовой нерасфасованной вакцины [45]. .
.
На самом деле, чтобы завершить трехвалентную или четырехвалентную нерасфасованную вакцину, жизненно важно определить количество антигена HA в каждой моновалентной нерасфасованной вакцине с помощью анализа однократной радиальной иммунодиффузии (SRID).SRID — это единственный подтвержденный анализ активности, и для его выполнения требуется наличие стандартных антигенов и специфических поликлональных антител. Подготовка и распространение специфических антител для анализа SRID остается дополнительным трудоемким этапом, который увеличивает сроки разработки и клинической оценки вакцины против гриппа. После количественного определения моновалентной массы можно составить трехвалентную массу. Трехвалентная масса содержит минимум 15 мкг г ГК каждого штамма на дозу и должна быть стабильной в течение 1 года.
Только четыре лаборатории (Управление терапевтических товаров (TGA), Австралия; Национальный институт инфекционных заболеваний (NIID), Япония; Национальный институт биологических стандартов и контроля (NIBSC), Великобритания; Центр оценки и исследований биологических препаратов (CBER), США ) поставлять реагенты по всему миру через 3 месяца после того, как ВОЗ объявила вакцинные штаммы-кандидаты. Однако получение стандартизирующих реагентов может стать узким местом в производстве противогриппозной вакцины. Более того, Европейское агентство по лекарственным средствам (EMA) требует проведения предварительного клинического исследования вакцины с новой формулой перед тем, как разрешить ее одобрение на рынке, что вынуждает производителей выпустить вакцину в форме в июне для завершения исследования [11, 17, 44].
Однако получение стандартизирующих реагентов может стать узким местом в производстве противогриппозной вакцины. Более того, Европейское агентство по лекарственным средствам (EMA) требует проведения предварительного клинического исследования вакцины с новой формулой перед тем, как разрешить ее одобрение на рынке, что вынуждает производителей выпустить вакцину в форме в июне для завершения исследования [11, 17, 44].
3. Производство вакцин на основе клеточных культур
Опираясь на значительный прогресс, достигнутый в технологии культивирования клеток млекопитающих, производители противогриппозных вакцин вложили средства в клеточные культуры для массового производства штаммов вируса гриппа.
3.1. Производство вакцины против гриппа с использованием культуры клеток млекопитающих
Культура клеток млекопитающих является хорошо зарекомендовавшей себя технологией производства терапевтических белков или вакцин в биофармацевтической промышленности (ВПЧ, полиомиелит, mAb) [46, 47]. Несколько клеток млекопитающих были оценены на продукцию частиц гриппа и, в частности, клетки почки собаки Madin Darby (MDCK) [48, 49], эмбриональные клетки сетчатки человека (PER.C6) [50], клетки почки обезьяны (Vero) [51, 52] и клетки почки эмбриона человека (HEK293) [47] успешно прошли испытания для промышленного производства противогриппозных вакцин.
Несколько клеток млекопитающих были оценены на продукцию частиц гриппа и, в частности, клетки почки собаки Madin Darby (MDCK) [48, 49], эмбриональные клетки сетчатки человека (PER.C6) [50], клетки почки обезьяны (Vero) [51, 52] и клетки почки эмбриона человека (HEK293) [47] успешно прошли испытания для промышленного производства противогриппозных вакцин.
Еще в 2001 г. компания Solvay Biologicals получила лицензию Influvac в Нидерландах на сплит-вирусную вакцину, производимую на прикрепленных клетках MDCK.Производство Инфлювака осуществляли в бессывороточной среде с использованием микроносителей (Cytodex 3) для прикрепления клеток, а интактный вирус выделяли с помощью аффинной хроматографии, а затем обрабатывали как яичную вакцину для инактивации [53]. Производство Инфлювака, по-видимому, прекращено [54]. В настоящее время в клетках млекопитающих производятся три вакцины против гриппа, лицензированные FDA: Optaflu/Flucelvax (Novartis) и Preflucel и Celvapan (Baxter). Схематическое представление схем производства и очистки противогриппозной вакцины показано на рисунке 2.
3.2. Optaflu/Flucelvax
Эта вакцина была впервые одобрена в ЕС [54], а совсем недавно — FDA в 2012 г. [55]. Это трехвалентная субъединичная вакцина, состоящая из двух штаммов гриппа A (h2N1, h4N2) и одного штамма типа B, продуцируемая в клетках MDCK из адаптированных к яйцам семян вируса гриппа. Используемая клеточная линия MDCK 33016 растет в суспензии в бессывороточной и безбелковой среде [53, 54, 56].
В этом процессе семена вируса, рекомендованные для сезонной вакцинации, размножаются в культуре клеток MDCK 33016.Потомство вирусов гриппа выделяют из супернатанта с помощью последовательных стадий центрифугирования, фильтрации, химического разрушения и хроматографии для удаления клеточного детрита и отделения вируса от оставшихся примесей компонентов. Чтобы ограничить содержание ДНК менее чем 10 нг на дозу, добавляется бензоназа. Вирус инактивируют добавлением β -пропиолактона ( β -PL), а затем разрушают добавлением бромида цетилтриметиламмония (CTAB) для солюбилизации вирусных поверхностных антигенов HA и NA. Затем вирусный препарат ультрацентрифугируют [57]. Каждый из трех штаммов вируса производится и очищается отдельно, а затем объединяется для получения трехвалентной вакцины [54].
Затем вирусный препарат ультрацентрифугируют [57]. Каждый из трех штаммов вируса производится и очищается отдельно, а затем объединяется для получения трехвалентной вакцины [54].
3.3. Preflucel и Celvapan
Preflucel — это вакцина против сезонного гриппа компании Baxter, в состав которой входят инактивированные вирусы гриппа h2N1, h4N2 и вирус гриппа B, произведенные в клетках Vero и лицензированные в ЕС в 2010 г. [58]. Клетки Vero выращивают на микроносителе Cytodex 3. Клетки инфицируют при MOI приблизительно 0,01 TCID 50 мл -1 , супернатант очищают и обрабатывают бензоназой для деградации ДНК.Вирус инактивируется добавлением формалина. Последующий процесс продолжается ультрацентрифугированием для концентрирования и осаждения с использованием сульфата протамина с последующим центрифугированием в градиенте сахарозы, ультрафильтрацией и стерильной фильтрацией для окончательного состава [51, 59–62]. Компания Baxter разработала моновалентный Celvapan для H5N1 или h2N1, который был одобрен для коммерциализации в Европе в 2009 г. Для производства вакцины использовались клетки Vero, выращенные на микроносителях Cytodex 1 или 3 [46].Клетки инфицируют штаммом H5N1 или h2N1 для продукции вируса. Потомство вируса собирают и инактивируют путем добавления формальдегида и ультрафиолетового (УФ) облучения, а затем концентрируют ультрацентрифугированием в градиенте сахарозы. Продукт гомогенизируют и удаляют сахарозу с оставшимися примесями дополнительным циклом ультрацентрифугирования. Заключительный этап – стерильная фильтрация моновалентной массы [59].
Для производства вакцины использовались клетки Vero, выращенные на микроносителях Cytodex 1 или 3 [46].Клетки инфицируют штаммом H5N1 или h2N1 для продукции вируса. Потомство вируса собирают и инактивируют путем добавления формальдегида и ультрафиолетового (УФ) облучения, а затем концентрируют ультрацентрифугированием в градиенте сахарозы. Продукт гомогенизируют и удаляют сахарозу с оставшимися примесями дополнительным циклом ультрацентрифугирования. Заключительный этап – стерильная фильтрация моновалентной массы [59].
3.4. Производство вакцины против гриппа с использованием культуры клеток насекомых
Клетки насекомых и бакуловирусные экспрессионные векторные системы (BEVS) широко используются для производства рекомбинантных белков.Метод BEVS был успешно использован для производства рекомбинантной вакцины против рака VLP папилломавируса человека (Cervarix). BEVS и клетки насекомых используются для разработки ряда вакцин на основе VLP, которые проходят доклинические исследования (Эбола, вирус Хантаан, вирус гепатита С, вирус простого герпеса и норовирус). Поэтому клетки насекомых с общепринятым профилем безопасности все чаще рассматриваются для коммерческого производства вакцин [63].
Поэтому клетки насекомых с общепринятым профилем безопасности все чаще рассматриваются для коммерческого производства вакцин [63].
Альтернативным подходом к репликации полного вируса и обработке вирионов для противогриппозных вакцин является использование рекомбинантной технологии.Эта технология позволяет экспрессировать антигены вируса гриппа, такие как мономерные или множественные НА, а также аутособранные полностью свернутые белки, способные образовывать вирусоподобные частицы.
Protein Sciences лицензировала трехвалентную вакцину рекомбинантного гемагглютинина (HA), полученную в культуре клеток насекомых с использованием бакуловирусной системы экспрессии. FluBlok — первая рекомбинантная противогриппозная вакцина HA (трехвалентная), содержащая белок HA, полученный из рекомендованных ВОЗ трех штаммов гриппа, которые ежегодно обновляются.Антигены HA, включенные в FluBlok, представляют собой полноразмерные белки, содержащие трансмембранный домен и области HA1 и HA2. Состав FluBlok содержит в три раза (45 μ г) количество ГК TIV для каждого из трех подтипов. Он продемонстрировал отличную иммуногенную способность у молодых и пожилых людей, но не у детей [64, 65].
Он продемонстрировал отличную иммуногенную способность у молодых и пожилых людей, но не у детей [64, 65].
Производство FluBlok (рис. 3) осуществляется с использованием непрерывной линии клеток насекомых expressSF+, линии клеток насекомых, полученной из клеток Sf9, выращенных в бессывороточной среде.Каждый из трех рекомбинантных НА экспрессируется в клеточной линии, полученной из Sf9, с использованием бакуловирусного вектора [66].
При использовании рекомбинантной технологии не происходит селекции или адаптации штаммов вируса гриппа, что обеспечивает хорошее генетическое соответствие между вакцинными штаммами и циркулирующими штаммами вируса гриппа. Более того, все этапы производства FluBlok (клонирование, экспрессия и производство) могут быть выполнены за короткий период времени (менее 2 месяцев) и не требуют средств биозащиты высокого уровня по сравнению с пандемическими штаммами, которые необходимо манипулировали в условиях BSL3 [42].
Производство FluBlok включает в себя первоначальный процесс клонирования гена HA в вектор экспрессии бакуловируса. Полученный рекомбинантный бакуловирус затем используется для заражения клеток насекомых в крупномасштабных биореакторах. Инфицированные клетки собирают с помощью центрифугирования, антиген извлекают из клеток с помощью Triton X-100 и затем очищают с помощью глубинной фильтрации. HA очищают с помощью двух стадий колоночной хроматографии, ионообменной колонки с последующей колонкой с гидрофобным взаимодействием и двух стадий фильтрации, одной фильтрации с использованием Q-мембраны для удаления остаточной ДНК с последующей стадией ультрафильтрации.Очищенные ГК затем смешивают и расфасовывают во флаконы на одну дозу [67, 68]. Общий производственный процесс начинается с получения вирусных последовательностей, и в течение 45 дней начинается коммерческое производство, а продукт выпускается через 75 дней [68].
Полученный рекомбинантный бакуловирус затем используется для заражения клеток насекомых в крупномасштабных биореакторах. Инфицированные клетки собирают с помощью центрифугирования, антиген извлекают из клеток с помощью Triton X-100 и затем очищают с помощью глубинной фильтрации. HA очищают с помощью двух стадий колоночной хроматографии, ионообменной колонки с последующей колонкой с гидрофобным взаимодействием и двух стадий фильтрации, одной фильтрации с использованием Q-мембраны для удаления остаточной ДНК с последующей стадией ультрафильтрации.Очищенные ГК затем смешивают и расфасовывают во флаконы на одну дозу [67, 68]. Общий производственный процесс начинается с получения вирусных последовательностей, и в течение 45 дней начинается коммерческое производство, а продукт выпускается через 75 дней [68].
4. Новые технологии производства вакцины против гриппа
Эпитопы из структуры вируса гриппа, включая глобулярную головку НА, мономерный НА или свернутые рекомбинантные белки гриппа, которые генерируют вирусоподобные частицы (М, НА и NA ), были рекомбинантно экспрессированы в различных системах клеточных культур и других системах экспрессии. Увеличилось количество доклинических исследований и исследований на ранних стадиях разработки рекомбинантных вакцин-кандидатов [23, 69], что свидетельствует о новых тенденциях и внедрении современных технологий в производстве противогриппозных вакцин. В таблице 3 представлены разрабатываемые вакцины-кандидаты против гриппа, продуцируемые в настоящее время клеточными культурами.
Увеличилось количество доклинических исследований и исследований на ранних стадиях разработки рекомбинантных вакцин-кандидатов [23, 69], что свидетельствует о новых тенденциях и внедрении современных технологий в производстве противогриппозных вакцин. В таблице 3 представлены разрабатываемые вакцины-кандидаты против гриппа, продуцируемые в настоящее время клеточными культурами.
| |||||||||||||||||||||||||||||||||||||||||||||
4.
 1. ЖГВ, продуцируемые клетками
1. ЖГВ, продуцируемые клетками Исследователи также оценили продукцию ЖГВ культурами клеток [70, 71] с использованием либо клеток MDCK, либо клеток Vero [70, 72]. Nobilon и MedImmune использовали прилипшие клетки MDCK. В процессе производства MedImmune клетки MDCK выращивают на микроносителях Cytodex 3 и в бессывороточной среде для достижения выхода вируса 8,9 log 10 БОЕ/мл, измеренного с помощью анализа флуоресцентного фокуса (FFA) [73], что согласуется с высоким выход вируса, извлеченный из крупномасштабной клеточной культуры MDCK с использованием роллерных флаконов ( БОЕ·мл -1 ) [74].Собранные вирусы фильтруют и очищают от клеток. Осветленный урожай фильтруют (ультрафильтрация или диафильтрация) и добавляют бензоназу для расщепления ДНК. Для удаления остаточной ДНК и белков MDCK проводят аффинную хроматографию с последующей диафильтрацией. Последним этапом является стерильная фильтрация для восстановления интактного вируса. Таким образом, биореактор одноразового использования с рабочим объемом 30 л обеспечивает достаточное количество ЖГВ для приготовления примерно 2,4 млн доз моновалентной вакцины за один цикл. Для аналогичного количества доз ЖГВ потребовалось бы 4000–8000 яиц с эмбрионами [75]. Компании Vivaldi Biosciences и AVIR Green Hills Biotech разработали вирус гриппа с дефицитом репликации путем удаления гена NS1 с помощью обратной генетики и использования клеток Vero в качестве клеточных фабрик для производства ЖГВ [76–80].
Для аналогичного количества доз ЖГВ потребовалось бы 4000–8000 яиц с эмбрионами [75]. Компании Vivaldi Biosciences и AVIR Green Hills Biotech разработали вирус гриппа с дефицитом репликации путем удаления гена NS1 с помощью обратной генетики и использования клеток Vero в качестве клеточных фабрик для производства ЖГВ [76–80].
4.2. Вирусоподобные частицы Вакцина против гриппа
Вирусоподобные частицы (ВПЧ) представляют собой полые структуры, состоящие из структурных белков, которые самопроизвольно собираются с образованием частиц с такой же морфологией и антигенностью, что и нативный вирус.VLP являются структурами с дефектом генома и поэтому не могут инфицировать клетки [67]. VLP могут быть созданы с использованием методов, аналогичных тем, которые используются для создания полноценных вирусов. В отличие от расщепленных или субъединичных противогриппозных вакцин преимущество VLP состоит в том, что они имеют очень сходную презентацию поверхностного антигена, как и нативный вирус. ВПЧ гриппа образуются спонтанно, когда HA и M1 коэкспрессируются в клетке, с NA или без нее [23]. В случае клеток насекомых носителем, используемым для экспрессии VLP, является бакуловирус, кодирующий интересующие гены (Novavax).
ВПЧ гриппа образуются спонтанно, когда HA и M1 коэкспрессируются в клетке, с NA или без нее [23]. В случае клеток насекомых носителем, используемым для экспрессии VLP, является бакуловирус, кодирующий интересующие гены (Novavax).
Получение ВПЧ с использованием бакуловируса для заражения клеток насекомых описано López-Macías et al. 2011 [81]. Вкратце, VLP продуцируются в клетках Sf9, инфицированных рекомбинантным бакуловирусом насекомых, экспрессирующим гены HA, NA и M1. Рекомбинантный бакуловирус, содержащий три гена гриппа, был создан с использованием системы экспрессии Bac-to-Bac. Рекомбинантную бакмидную ДНК очищают и трансфицируют в клетки насекомых Sf9. Затем идентифицируют один рекомбинантный бакуловирус, экспрессирующий HA, NA и M1, очищают от бляшек, а затем амплифицируют для использования в производстве VLP гриппа A (h2N1) 2009.Производство рекомбинантных VLP по cGMP осуществляется в 100-литровом биореакторе Wave с клетками Sf9, инфицированными рекомбинантным бакуловирусом. ВПЧ h2N1 собирали через 72 часа с использованием предварительно стерилизованных одноразовых установок тангенциальной проточной фильтрации (TFF) для осветления, концентрирования и диафильтрации. Концентрированные VLP затем отделяют от примесей хозяина, бакуловирусов и нуклеиновых кислот с помощью ионообменной хроматографии, ультрацентрифугирования в градиенте сахарозы, диафильтрации в PBS и 0.22 мк м ступени фильтрации. Стерильные очищенные ВПЧ h2N1 2009 хранят при температуре 2–8°С и стабильны при хранении при этой температуре не менее 1 года.
ВПЧ h2N1 собирали через 72 часа с использованием предварительно стерилизованных одноразовых установок тангенциальной проточной фильтрации (TFF) для осветления, концентрирования и диафильтрации. Концентрированные VLP затем отделяют от примесей хозяина, бакуловирусов и нуклеиновых кислот с помощью ионообменной хроматографии, ультрацентрифугирования в градиенте сахарозы, диафильтрации в PBS и 0.22 мк м ступени фильтрации. Стерильные очищенные ВПЧ h2N1 2009 хранят при температуре 2–8°С и стабильны при хранении при этой температуре не менее 1 года.
4.3. Вакцина против векторного гриппа
Другой альтернативной вакциной против гриппа является векторная вакцина против гриппа. В этой системе используются реплицирующиеся рекомбинантные конструкции на основе вируса, отличного от вируса гриппа, для заражения и иммунизации субъекта. Различные векторные системы, такие как аденовирус, поксвирус, вирус парагриппа и альфавирус, использовались для экспрессии НА гриппа и других белков вируса гриппа в рекомбинантных вакцинах-кандидатах для сезонного, а также пандемического вируса птичьего гриппа человека.
Основным преимуществом этих векторов является то, что их сайты-мишени аналогичны сайтам-мишеням вируса гриппа. Аденовирусы, например, естественным образом воздействуют на рецепторы слизистой оболочки. Аденовирусные векторы широко использовались в качестве систем доставки для лечения нескольких инфекционных заболеваний (гепатит В, бешенство, сибирская язва, лихорадка Эбола, атипичная пневмония и ВИЧ-1) [82].
Дефектные аденовирусные частицы, экспрессирующие НА, доставленные интраназально, обладают доказанной способностью индуцировать врожденный и адаптивный иммунный ответ [23].Было проведено несколько исследований с использованием аденовирусов в качестве векторов. Клиническое исследование фазы 2, проведенное Van Kampen et al. показали, что как назальное, так и подкожное введение Ad5-HAPR8 добровольцам-людям вызывает титры сывороточных антител, но с высокой активностью при назальном введении [83]. Клетки HEK293 использовали для продукции аденовируса. Вектор извлекали ультрацентрифугированием в градиенте хлорида цезия с последующим диализом. Очищенные вирусы стерилизовали фильтрованием, разделяли на аликвоты и хранили при -80°С [84].Другое клиническое испытание (фаза 1) с использованием рекомбинантного аденовируса rAd, экспрессирующего НА птичьего гриппа Н5 (rAd5-HA-TLR3), показало, что пероральное введение вакцины оказывает положительное влияние на индукцию иммунных ответов на антиген [85]. Более того, иммунный ответ реплицирующейся векторной вакцины Ad4, экспрессирующей НА птичьего гриппа H5N1, оценивали в фазе 1 клинических испытаний. Вектор вводили перорально и индуцировали клеточный иммунный ответ, который усиливался при введении инактивированной вакцины H5N1 [86].Другой подход может включать использование аденовируса обезьян с дефицитом репликации, экспрессирующего консервативные белки вируса гриппа NP и M1. Векторная вакцина индуцировала сильный Т-клеточный иммунный ответ против нескольких штаммов гриппа при тестировании на людях [87]. Модели на мышах также показали высокие уровни гуморального и клеточного иммунного ответа и были защищены от репликации вируса после заражения вирусами птичьего гриппа H5, H7 и H9 [88].
Очищенные вирусы стерилизовали фильтрованием, разделяли на аликвоты и хранили при -80°С [84].Другое клиническое испытание (фаза 1) с использованием рекомбинантного аденовируса rAd, экспрессирующего НА птичьего гриппа Н5 (rAd5-HA-TLR3), показало, что пероральное введение вакцины оказывает положительное влияние на индукцию иммунных ответов на антиген [85]. Более того, иммунный ответ реплицирующейся векторной вакцины Ad4, экспрессирующей НА птичьего гриппа H5N1, оценивали в фазе 1 клинических испытаний. Вектор вводили перорально и индуцировали клеточный иммунный ответ, который усиливался при введении инактивированной вакцины H5N1 [86].Другой подход может включать использование аденовируса обезьян с дефицитом репликации, экспрессирующего консервативные белки вируса гриппа NP и M1. Векторная вакцина индуцировала сильный Т-клеточный иммунный ответ против нескольких штаммов гриппа при тестировании на людях [87]. Модели на мышах также показали высокие уровни гуморального и клеточного иммунного ответа и были защищены от репликации вируса после заражения вирусами птичьего гриппа H5, H7 и H9 [88]. Были проведены и другие исследования на животных моделях, которые указывают на устойчивый защитный иммунитет против вируса гриппа [89, 90].
Были проведены и другие исследования на животных моделях, которые указывают на устойчивый защитный иммунитет против вируса гриппа [89, 90].
Небольшое производство и размножение аденовируса поддерживается в зависимой от привязки упаковочной клеточной линии, культивируемой в роллерных флаконах, Т-колбах или клеточных фабриках [91]. Очистка в этом масштабе обычно состоит из простого центрифугирования в градиенте плотности с хлоридом цезия (CsCl) с выходом примерно вирусных частиц (ВЧ), достаточным для клинических исследований.
Однако важно разработать крупномасштабные процессы производства и очистки для получения больших количеств вирусного вектора (>10 15 VP), необходимых для дальнейших клинических исследований и коммерциализации.
Биореакторные системы можно использовать для получения аденовирусных векторов с использованием крупномасштабных клеточных культур. Аденовирусные векторы были получены в крупномасштабных биореакторных системах с микроносителями с использованием клеток эмбриональной почки человека (HEK) 293 с получением VP или в суспензионной культуре с использованием PER. C6 и 293SF [82]. Волновые биореакторы и биореакторы с мешалкой являются основными платформами, используемыми для крупномасштабного производства аденовирусных векторов. Извлечение до VPs было достигнуто из 500 л клеточной культуры PER.C6 в волновом биореакторе, экспрессирующем Ad5 [92].Совсем недавно значение ~ VPs было получено для репликации Ad5 (AdRG1.3), экспрессированной в суспензионной культуре клеток 293N3S в 500-литровом биореакторе [93].
C6 и 293SF [82]. Волновые биореакторы и биореакторы с мешалкой являются основными платформами, используемыми для крупномасштабного производства аденовирусных векторов. Извлечение до VPs было достигнуто из 500 л клеточной культуры PER.C6 в волновом биореакторе, экспрессирующем Ad5 [92].Совсем недавно значение ~ VPs было получено для репликации Ad5 (AdRG1.3), экспрессированной в суспензионной культуре клеток 293N3S в 500-литровом биореакторе [93].
Хотя традиционная система очистки CsCl подходит для мелкосерийного производства, она непрактична в крупномасштабном производстве. Альтернативные методы очистки основаны на методах хроматографии. Процесс очистки продукции аденовируса состоит из начального этапа лизиса клеток осмотическим шоком или микрофлюидизацией концентрированного урожая.Лизат клеток обрабатывают бензоназой для удаления ДНК, а затем центрифугируют. Супернатант фильтруют и подвергают анионообменной хроматографии с эффективностью извлечения 80%. Аденовирус концентрируют с помощью ультрафильтрации, а затем полируют с использованием колонки для эксклюзионной хроматографии с выделением аденовируса чистоты 99% [94]. Влияние хроматографических стадий на инфекционность аденовируса оказалось очень низким. Этот вывод является ключевым фактором в сценарии пандемии, когда в течение короткого периода времени потребуются большие количества высокоочищенных вакцин на основе Ad.Весь процесс от идентификации вакцинного вируса до приготовления вакцины с использованием вакцинной технологии на основе аденовирусного вектора занимает приблизительно от 11 до 13 недель [82].
Влияние хроматографических стадий на инфекционность аденовируса оказалось очень низким. Этот вывод является ключевым фактором в сценарии пандемии, когда в течение короткого периода времени потребуются большие количества высокоочищенных вакцин на основе Ad.Весь процесс от идентификации вакцинного вируса до приготовления вакцины с использованием вакцинной технологии на основе аденовирусного вектора занимает приблизительно от 11 до 13 недель [82].
5. Выводы
Технология на основе яиц по-прежнему широко используется производителями противогриппозных вакцин и будет использоваться в течение многих лет, поскольку она продемонстрировала выдающуюся надежность.
Тем временем несколько новых методов производства гриппозной вакцины на основе клеточных культур получили коммерческую лицензию за последние несколько лет (Flucelvax/Optaflu, Celvapan и Preflucel), в то время как многие вакцины-кандидаты против гриппа, использующие новые технологии производства, показывают многообещающие результаты в доклинических исследованиях. этапы оценки.FluBlok можно выделить как один из наиболее важных шагов вперед в разработке вакцин на основе технологии клеточных культур благодаря более эффективной системе производства. Рекомбинантные вакцины также стали альтернативой традиционной вакцине против гриппа. Обратная генетика является мощным инструментом для использования в разработке реассортантов с высоким ростом гриппа, упрощая громоздкую традиционную систему. Клеточная ЖГВ доказала свою эффективность в ходе испытаний фазы 1 и фазы 2. Вакцины против гриппа VLP также являются надежными кандидатами для рассмотрения, поскольку Novavax завершила клинические испытания фазы 2.Точно так же векторные вакцины с особым вниманием к аденовирусным вакцинам продемонстрировали большой потенциал в клинических испытаниях.
этапы оценки.FluBlok можно выделить как один из наиболее важных шагов вперед в разработке вакцин на основе технологии клеточных культур благодаря более эффективной системе производства. Рекомбинантные вакцины также стали альтернативой традиционной вакцине против гриппа. Обратная генетика является мощным инструментом для использования в разработке реассортантов с высоким ростом гриппа, упрощая громоздкую традиционную систему. Клеточная ЖГВ доказала свою эффективность в ходе испытаний фазы 1 и фазы 2. Вакцины против гриппа VLP также являются надежными кандидатами для рассмотрения, поскольку Novavax завершила клинические испытания фазы 2.Точно так же векторные вакцины с особым вниманием к аденовирусным вакцинам продемонстрировали большой потенциал в клинических испытаниях.
Несмотря на достижения, сохраняется насущная потребность в традиционном производстве на основе яиц, и для дальнейшего развития вакцин на основе клеточных культур производителям необходимо сделать свои вакцины максимально эффективными, а также как можно быстрее доставить их. Эти достижения будут необходимы для реагирования на пандемическую вспышку вируса гриппа, которая, по прогнозам, станет потенциальной угрозой в ближайшие годы.
Эти достижения будут необходимы для реагирования на пандемическую вспышку вируса гриппа, которая, по прогнозам, станет потенциальной угрозой в ближайшие годы.
Создание гибкой и масштабируемой системы снабжения населения мира вакциной против гриппа с учетом безопасности и экономической эффективности остается одной из основных задач производителей вакцин против гриппа, а также национальных и международных агентств общественного здравоохранения.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
| Аденовирусная вакцина типа 4 и типа 7, живая, пероральная | Нет торгового названия |
| Вакцина против сибирской язвы адсорбированная | Биотракс |
| БЦЖ Live | Вакцина БЦЖ |
| БЦЖ Live | ТИСЕ БКГ |
| Вакцина против холеры живая пероральная | Вахчора |
| Вакцина против COVID-19, мРНК | Комирнаты |
| Тетравалентная вакцина против денге, живая | ДЕНГВАКСИЯ |
| Анатоксины дифтерии и столбняка Адсорбированные | Нет торгового названия |
| Дифтерийно-столбнячный анатоксин и бесклеточная вакцина против коклюша Адсорбированная | Инфанрикс |
| Дифтерийно-столбнячный анатоксин и бесклеточная вакцина против коклюша Адсорбированная | ДАПТАСЕЛЬ |
| Дифтерийно-столбнячный анатоксин и бесклеточная вакцина против коклюша Адсорбированная, против гепатита В (рекомбинантная) и комбинированная вакцина против инактивированного полиовируса | Педиарикс |
| Дифтерийно-столбнячный анатоксин и бесклеточный коклюш Адсорбированная и инактивированная полиовирусная вакцина | КИНРИКС |
| Дифтерийно-столбнячный анатоксин и бесклеточный коклюш Адсорбированная и инактивированная полиовирусная вакцина | Квадроцикл |
| Дифтерийный и столбнячный анатоксины и бесклеточный коклюш Адсорбированный, инактивированный полиовирус, конъюгат Haemophilus b [конъюгат менингококкового белка] и вакцина против гепатита B [рекомбинантная] | ВАКСЕЛИС |
| Дифтерийный и столбнячный анатоксины и бесклеточный коклюш Адсорбированный, инактивированный полиовирус и конъюгат Haemophilus b (конъюгат столбнячного анатоксина) Вакцина | Пентацель |
| Вакцина против лихорадки Эбола Заир, живая | ЭРВЕБО |
| Конъюгированная вакцина против Haemophilus b (конъюгат менингококкового белка) | PedvaxHIB |
| Конъюгированная вакцина против Haemophilus b (конъюгат столбнячного анатоксина) | ActHIB |
| Конъюгированная вакцина против Haemophilus b (конъюгат столбнячного анатоксина) | Хиберикс |
| Вакцина против гепатита А, инактивированная | Хаврикс |
| Вакцина против гепатита А, инактивированная | ВАКТА |
| Инактивированная вакцина против гепатита А и вакцина против гепатита В (рекомбинантная) | Твинрикс |
| Вакцина против гепатита В (рекомбинантная) | Рекомбивакс HB |
| Вакцина против гепатита В (рекомбинантная) | ПРЕХЕВБРИО |
| Вакцина против гепатита В (рекомбинантная) | Энджерикс-Б |
| Вакцина против гепатита В (рекомбинантная), с адъювантом | ХЕПЛИСАВ-Б |
| Вакцина против папилломавируса человека четырехвалентная (типы 6, 11, 16, 18), рекомбинантная | Гардасил |
| Вакцина против вируса папилломы человека, 9-валентная, рекомбинантная | Гардасил 9 |
| Вакцина против папилломавируса человека бивалентная (типы 16, 18), рекомбинантная | Церварикс |
| Грипп A (h2N1) 2009 Моновалентная вакцина | Нет торгового названия |
| Грипп A (h2N1) 2009 Моновалентная вакцина | Нет торгового названия |
| Грипп A (h2N1) 2009 Моновалентная вакцина | Нет торгового названия |
| Грипп A (h2N1) 2009 Моновалентная вакцина | Нет торгового названия |
| Грипп A (h2N1) 2009 Моновалентная вакцина | Нет торгового названия |
| Вакцина против вируса гриппа H5N1 (для национального запаса) | Нет торгового названия |
| Моновалентная вакцина против вируса гриппа A (H5N1) с адъювантом | Нет торгового названия |
| Моновалентная вакцина против гриппа A (H5N1) с адъювантом | АУДЕНЦ |
| Вакцина против гриппа, адъювантная | Четырехвалентный флюад |
| Вакцина против гриппа, адъювантная | Флюад |
| Вакцина против гриппа | Афлурия четырехвалентная, Афлурия четырехвалентная Южное полушарие |
| Вакцина против гриппа | Флюцелвакс Четырехвалентный |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Афлурия, Афлурия Южное полушарие |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | ФлуЛаваль |
| Вакцина против гриппа, живая, интраназальная (трехвалентная, типы A и B) | FluMist |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Флуарикс |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Флувирин |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Агрифлю |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Fluzone, Fluzone High-Dose и Fluzone Intradermal |
| Вакцина против вируса гриппа (трехвалентная, типы A и B) | Флуцелвакс |
| Вакцина против гриппа (трехвалентная) | Флюблок |
| Вакцина против гриппа (четырехвалентная) | Флублок Четырехвалентный |
| Вакцина против гриппа, живая, интраназальная (четырехвалентная, типы A и типы B) | Четырехвалентный туман FluMist |
| Вакцина против вируса гриппа (четырехвалентная, типы A и типы B) | Четырехвалентный датчик Fluarix |
| Вакцина против вируса гриппа (четырехвалентная, типы A и типы B) | Четырехвалентный флюзон |
| Вакцина против гриппа | Флулаваль Четырехвалентный |
| Вакцина против вируса японского энцефалита, инактивированная, адсорбированная | Иксиаро |
| Вакцина против кори, эпидемического паротита и краснухи, живая | М-М-Р II |
| Живая вакцина против кори, эпидемического паротита, краснухи и ветряной оспы | ProQuad |
| Менингококковая (группы A, C, Y и W-135) олигосахаридная дифтерийная конъюгированная вакцина CRM197 | Менвео |
| Менингококковая (группы A, C, Y и W-135) полисахаридная конъюгированная вакцина против дифтерийного анатоксина | Менактра |
| Менингококковая вакцина группы B | БЕКССЕРО |
| Менингококковая вакцина группы B | ТРУМЕНБА |
| Менингококковая полисахаридная вакцина, группы A, C, Y и W-135 Комбинированная | Меномун-A/C/Y/W-135 |
| Менингококковая (группы A, C, Y, W) конъюгированная вакцина | МужчиныQuadfi |
| Вакцина против чумы | Торговое наименование отсутствует |
| Пневмококковая вакцина поливалентная | Пневмовакс 23 |
| Пневмококковая 13-валентная конъюгированная вакцина (дифтерийный CRM 197 Белок) | Превнар 13 |
| Пневмококковая 15-валентная конъюгированная вакцина | ВАКСНЕВАНС |
| Пневмококковая 20-валентная конъюгированная вакцина | Превнар 20 |
| Вакцина против полиомиелита, инактивированная (диплоидная клетка человека) | Полиовакс |
| Вакцина против полиомиелита, инактивированная (клетки почки обезьяны) | ИПОЛ |
| Вакцина против бешенства | Имовакс |
| Вакцина против бешенства | РабАверт |
| Адсорбированная вакцина против бешенства | Нет торгового названия |
| Ротавирусная вакцина, живая, пероральная | РОТАРИКС |
| Ротавирусная вакцина, живая, пероральная, пятивалентная | Ротатек |
| Вакцина против оспы и оспы обезьян, живая, нереплицируемая | ДЖИННЕОС |
| Вакцина против оспы (Vaccinia), живая | АКАМ2000 |
| Анатоксины столбняка и дифтерии, адсорбированные | ТДВАКС |
| Анатоксины столбняка и дифтерии, адсорбированные для взрослых | ТЕНИВАК |
| Столбнячный анатоксин Адсорбированный | Нет торгового названия |
| Столбнячный анатоксин, редуцированный дифтерийный анатоксин и бесклеточная коклюшная вакцина, адсорбированная | Адасель |
| Столбнячный анатоксин, редуцированный дифтерийный анатоксин и бесклеточная коклюшная вакцина, адсорбированная | Бустерикс |
| Вакцина против клещевого энцефалита | ТИКОВАК |
| Вакцина против брюшного тифа Живая пероральная Ty21a | Вивотив |
| Полисахаридная вакцина против брюшного тифа Vi | ТИФИМ Vi |
| Живая вакцина против вируса ветряной оспы | Варивакс |
| Вакцина против желтой лихорадки | YF-Вакс |
| Вакцина Zoster, живая, (Oka/Merck) | Зоставакс |
| Рекомбинантная вакцина против опоясывающего лишая с адъювантом | ШИНГРИКС |





 Ваш врач обсудит с вами преимущества и риски приема Инфлювак во время беременности
Ваш врач обсудит с вами преимущества и риски приема Инфлювак во время беременности
